Introduzione
In Italia nel 2017 sono stati stimati 369.000 nuovi casi di tumore, 192.000 negli uomini e 177.000 per le donne. Sono previsti 6-7 nuovi casi per 1000 uomini e 5 per 1000 donne. Ogni giorno vengono diagnosticati 1000 nuovi malati e 30 sono al di sotto dei 40 anni (AIOM sett. 2017). Per quanto gli indici di mortalità siano in calo, grazie all’introduzione nella pratica clinica di terapie innovative efficaci, ma comunque sempre molto dispendiose sia in termini di costi umani oltre che economici, a tutt’oggi meno del 50% delle neoplasie maligne è guaribile. Il miglior trattamento resta sempre la prevenzione.
Infatti quando un tumore viene diagnosticato, anche con le migliori e più avanzate tecnologie disponibili, ha già trascorso più del 90% della sua vita biologica e purtroppo le migliori chance di guarigione e/o di cura sono state verosimilmente compromesse. Nell’ultima decade sono stati fatti notevoli progressi nella comprensione della carcinogenesi e delle alterazioni molecolari all’origine dei tumori solidi, oltre che nello screening e nella diagnosi precoce, grazie al coinvolgimento di molte branche specialistiche. Anche perseguire l’obiettivo di riduzione della morbilità e mortalità da cancro necessita di un nuovo approccio multidisciplinare. La prevenzione dei tumori non solo si basa su adeguate conoscenze inerenti l’eziologia e la patogenesi dei tumori nei singoli organi, ma anche sull’identificazione dei soggetti a rischio per caratteristiche familiari o genetiche e per influenze ambientali o professionali. Queste considerazioni impongono un cambio di strategia che preveda una maggiore e più stretta collaborazione tra oncologo, medico di medicina generale, anatomo patologo, biologo molecolare, radiologo, specialisti di diverse branche, infermieri, malati ed associazioni di volontariato per elaborare percorsi interdisciplinari appropriati ed efficaci.
Storia naturale dei tumori e livelli di prevenzione
La prevenzione del cancro si basa sulla conoscenza della storia naturale della malattia (fig. 1).
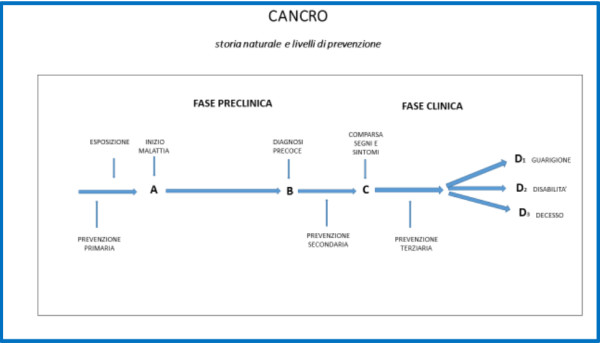
La prima fase è definita “preclinica “. Durante questo lungo periodo si assiste alla comparsa di tutte quelle alterazioni genetiche ed a quella serie di eventi che rendono il processo neoplastico irreversibile. La malattia poi va incontro a progressione e compaiono i primi segni e sintomi che inducono il malato a recarsi dal medico per la diagnosi. Inizia quindi la fase “clinica” che potrà evolvere verso la guarigione, la cronicità o il decesso.
Questo percorso si basa su una concezione di malattia evolutiva a genesi multifattoriale che diventa irreversibile grazie ad una serie di alterazioni patologiche sequenziali. Scopo della prevenzione è intervenire nelle varie fasi della progressione neoplastica per bloccare questo processo a vari livelli con le seguenti modalità:
1 prevenzione primaria: si attua riducendo l’esposizione individuale o incrementando le difese nei confronti dei fattori di rischio e quindi evitando le alterazioni cellulari all’origine del tumore. Le misure da adottare sono rivolte a soggetti asintomatici e sono molteplici (modifica degli stili di vita, chemio-prevenzione, vaccini etc.).
2. prevenzione secondaria: si attua nella fase preclinica e si basa sostanzialmente sugli screenings. Infatti dal punto B al punto C la malattia ha raggiunto dimensioni tali da renderla rilevabile con le attuali tecnologie, prima che si manifestino i sintomi.
3. prevenzione terziaria: si attua in fase clinica, quando il tumore si è già sviluppato e si basa su trattamenti e programmi di riabilitazione volti a limitare o migliorare gli effetti della neoplasia sui malati, intervenendo anche farmacologicamente per evitare la comparsa di secondi tumori.
La prevenzione primaria
Il primo passo ed elemento chiave alla base di una corretta strategia preventiva è l’individuazione dei soggetti a rischio. Un’anamnesi completa volta ad esplorare le patologie familiari e personali, l’esposizione professionale, gli stili di vita, consente di identificare i fattori di rischio sia modificabili (es. uso di tabacco, esposizione al sole) che non modificabili (es. storia familiare di cancro, sesso, razza, età avanzata, assetto ormonale).
A tale proposito sono stati elaborati dei modelli di calcolo che quantificano il rischio di cancro. Uno di questi è il modello di Gail per il carcinoma mammario. Si basa sulla valutazione di alcuni parametri come età, razza, menarca, età del primo parto, numero di biopsie mammarie, presenza o assenza di iperplasia atipica, familiarità positiva per carcinoma mammario.
La familiarità è importante giacché la gran parte dei tumori nella popolazione generale può essere definita sporadica, ma circa il 10% delle neoplasie è su base ereditaria, dovuta a mutazioni di geni come BRCA1 e BRCA2. Gran parte di queste alterazioni geniche possono essere rilevate con un semplice esame del sangue o con un prelievo di tessuto. Attualmente queste indagini e l’eventuale consulenza genetica sono regolarmente raccomandate per soggetti la cui storia personale o familiare suggerisce la presenza di una diatesi ereditaria di neoplasia. In caso si rilevi la presenza di una mutazione, l’esame viene esteso anche ai familiari più prossimi e può condizionare un diverso approccio inerente screening, chemio-prevenzione e chirurgia profilattica.
Alle sindromi geneticamente determinate si aggiunge un 15-20% di neoplasie familiari, dovute a geni di bassa penetranza che mutano per effetto di fattori ambientali o comportamenti a rischio. Questi, come si descriverà più avanti, sono per la gran parte modificabili e rappresentano la vera sfida da affrontare per la prevenzione oncologica.
Il fumo di tabacco
È al primo posto tra i comportamenti a rischio perché causa dipendenza psicologica e biochimica, danneggia i fumatori oltre che i non fumatori, vittime del cosiddetto “fumo passivo”. È responsabile di circa un terzo delle morti per cancro grazie a molte sostanze chimiche e ad almeno 69 cancerogene conosciute che possono agire danneggiando i tessuti con meccanismo diretto oppure provocando processi infiammatori e rottura delle barriere fisiologiche. Tumori attribuiti al tabagismo sono più frequentemente quelli polmonari, ma è stata provata correlazione anche con quelli del sangue, della testa e collo, dell’esofago, del pancreas, del fegato, dello stomaco, della cervice, del rene, del colon, della vescica, della prostata. La prevenzione ideale nei confronti di tutte queste neoplasie è evitare il fumo di tabacco soprattutto nei giovani, attivando campagne divulgative ed informative.
Smettere di fumare ha effetti benefici sulla salute che sono evidenti precocemente dal momento della sospensione, anche nei fumatori inveterati. Dopo 10 aa dall’astensione completa il rischio di mortalità per cancro del polmone si riduce della metà e dopo 30 anni scende ulteriormente fino al 10%.
L’intensa esposizione ai raggi solari
In particolare agli ultravioletti, soprattutto nei bambini, aumenta l’incidenza di tumori cutanei, in particolare di melanomi che hanno una particolare tendenza a metastatizzare ed una elevata mortalità. Il melanoma è aumentato dal 3% al 7% nelle popolazioni europee in questi ultimi anni, con punte massime di 20 vittime ogni 100mila abitanti. Frequenti scottature raddoppiano il rischio di melanoma e si associano ad una significativa presenza di carcinomi basocellulari. Anche i lettini abbronzanti sono ritenuti pericolosi, per cui l’Organizzazione Mondiale della Sanità (WHO) ha raccomandato di non usarli prima dei 18 anni.
La prevenzione si attua limitando l’esposizione al sole quando è più intenso, dalle ore 10-11 fino alle ore 15-16, applicando sempre su tutto il corpo creme protettive contro i raggi ultravioletti A e B, che abbiano un filtro ad ampio spettro con fattore di protezione almeno 30. La quantità di crema da applicare dovrebbe essere circa 20-30 g., pari ad una tazzina da caffè o un bicchierino da liquore. Il prodotto andrebbe spalmato una prima volta 30 minuti prima dell’esposizione, poi ripetuto ogni 2-4 ore ed eventualmente dopo il bagno, a seconda del tipo di crema. A queste precauzioni andrebbero aggiunti abiti, cappelli ed occhiali di protezione, soprattutto in soggetti molto giovani con pelli chiare.
Dieta, esercizio fisico, obesità, consumo di alcolici
Oltre a quanto considerato fino a questo punto, un rilevante contributo alla prevenzione primaria può venire da altri fattori strettamente correlati tra loro quali dieta, esercizio fisico, obesità, consumo di alcolici. Le abitudini alimentari sono importantissime, infatti non a caso si dice che la prima prevenzione la attuano le mamme quando fanno la spesa. L’uso eccessivo di grassi animali, l’alimentazione povera di frutta e verdura favoriscono lo sviluppo di adenomi e carcinomi del colon, l’abuso di alcolici incrementa il rischio di cancro del 4% negli uomini e del 6% nelle donne. Analogamente l’obesità aumenta del 14% la mortalità per cancro nell’uomo e del 20% nella donna e la vita sedentaria ne causa un incremento del 5%. È consigliabile fare almeno 5 pasti di frutta e verdura al giorno, alimentarsi prevalentemente con cereali integrali e zuccheri non raffinati, limitando il consumo di alcol ad un bicchiere al giorno per le donne e due per l’uomo; riducendo l’introito di carni rosse, insaccate, ricche di grassi; evitando un eccessivo incremento ponderale. A questo proposito evidenze in letteratura documentano che nei soggetti obesi sottoposti a chirurgia bariatrica il rischio di mortalità per tumore cala del 60%.
Attività sessuale o abitudini promiscue
Stili di vita scorretti o disordinati, non solo inerenti le abitudini alimentari, ma anche altri ambiti come l’attività sessuale o abitudini promiscue possono incrementare il rischio di tumori che riconoscono un’eziopatogenesi infettiva. Circa il 17% delle neoplasie è secondario ad infezioni. Esempi sono il virus del papilloma umano (HPV), responsabile della comparsa di carcinomi anogenitali e della cervice uterina, i virus dell’epatite B e C (HCV ed HBV), causa di carcinomi epatocellulari (HCC), il virus umano HTLV-I, correlato alla leucemia a cellule T dell’adulto, il virus Herpes (HHV-8) e quello dell’immunodeficienza umana (HIV), promotori dello sviluppo di sarcomi di Kaposi e di linfomi non Hodgkin. Questi ultimi tumori sono spesso associati anche al virus di Epstein–Barr. Inoltre tra gli agenti infettivi si riconoscono alcuni batteri, ad esempio l’ Helicobacter pylori (HP), che possono essere coinvolti nello sviluppo di neoplasie come il carcinoma gastrico o alcune forme di malattie linfoproliferative.
Per i soggetti a rischio la prevenzione si attua evitando la trasmissione virale con l’uso di vaccini, ausili e presidi sterili, screening di donatori di sangue, metodi di barriera e condom durante l’atto sessuale. Per i soggetti che hanno già contratto l’infezione è indicato l’uso di farmaci come gli inibitori di pompa e gli antibiotici nel caso di HP e di terapie antivirali nel caso di HCV o HIV.
Esposizione ambientale ed occupazionale a cancerogeni
Prima di affrontare l’importante capitolo della prevenzione secondaria e degli screenings non si può concludere quello della prevenzione primaria senza citare uno dei fattori più importanti nella cancerogenesi umana: l’esposizione ambientale ed occupazionale a cancerogeni. La presenza nell’aria o nell’acqua di agenti chimici come benzene, cadmio, uranio, asbesto o nickel incrementa notevolmente il rischio di cancro. Esempi sono la frequente insorgenza di carcinomi vescicali nei lavoratori delle industrie tessili, petrolifere, metallurgiche, chimiche; di tumori polmonari e di mesoteliomi in soggetti esposti al radon o all’asbesto; di tumori cutanei causati dall’arsenico.
L’Agenzia Internazionale per la Ricerca sul Cancro (IARC) ha suddiviso in gruppi le sostanze cancerogene. Attualmente 108 sostanze sono classificate nel gruppo 1 e sono ritenuti certamente responsabili dello sviluppo di neoplasie. Altre 66 sono classificate nel gruppo 2A e sono ritenuti probabili cancerogeni nell’uomo.
L’unica strategia preventiva efficace nei confronti della cancerogenesi secondaria ad esposizione ambientale o occupazionale a queste sostanze è evitare il contatto o la contaminazione con esse.
La prevenzione secondaria e gli screenings
In questo ambito gli screenings sui tumori più frequenti giocano un ruolo fondamentale. Sono indagini effettuate su un’ampia popolazione sana per cui devono avere alcune caratteristiche. Devono essere sicuri, per non esporre a rischi; accettabili, per garantire adeguata adesione; sostenibili economicamente, per non gravare eccessivamente sui servizi sanitari; utili, per offrire adeguato impatto sulla storia della malattia; attendibili con specificità molto alta e buon livello di sensibilità, per essere il più possibile affidabili.
Al momento sono considerati efficaci nei confronti del carcinoma della mammella, della cervice uterina e del colon retto, possibili nei confronti del carcinoma polmonare e della prostata, non raccomandati per il carcinoma dell’ovaio e dell’endometrio. Solo i primi tre saranno oggetto di questa trattazione.
Uno studio statistico basato su metanalisi ha stimato una riduzione della mortalità per carcinoma mammario del 34% a 7 anni nei soggetti sottoposti a screening mammografico. mammografia, soprattutto al di sopra dei 50anni di età. In Italia infatti si propone una mammografia ogni due anni per le donne dai 50 ai 69 anni. Per le donne di età inferiore, tra i 40 ed i 49 anni, l’incidenza del cancro mammario e la sensibilità della mammografia sono più basse, per cui in alcune regioni si sta proponendo l’estensione della mammografia con cadenza annuale in questa fascia di età. Nelle donne al di sopra dei 70 anni lo screening mammografico è piuttosto controverso, sia per l’attesa di vita più breve, sia per la difficoltà di verificare il reale impatto sulla sopravvivenza del programma di prevenzione. In linea di massima sembrerebbe ragionevole proporre di proseguire l’esecuzione della mammografia quando ci siano almeno 10 anni di aspettativa di vita.
Il rischio radiologico dovuto alla ripetizione degli esami, si può considerare trascurabile, eccetto che nelle donne portatrici di mutazione del gene BRCA, maggiormente sensibili agli effetti delle radiazioni. A tale proposito alcuni hanno suggerito di sostituire la mammografia con la risonanza magnetica (MRI) ma al momento non è proponibile un uso della MRI su larga scala. In donne ad alto rischio ha mostrato maggiore sensibilità ma minore specificità in uno studio comparativo nei confronti della mammografia con un eccesso di falsi positivi e di conseguenti biopsie.
Una RMN mammaria annuale attualmente viene raccomandata solo nelle donne portatrici di mutazione del gene BRCA o altre mutazioni note della linea germinale e altre situazioni che condizionino un alto rischio di cancro della mammella, in coloro che hanno familiari di primo grado portatori di mutazioni, in soggetti con anamnesi personale di mammelle sottoposte a radiazioni tra i 10 ed i 30 anni.
Subito dopo il carcinoma della mammella il cancro della cervice uterina è la neoplasia per la quale esistono le maggiori evidenze di efficacia dello screening grazie al test di Papanicolau (PAP test). Questo test non è mai stato sottoposto ad un trial clinico randomizzato, ma viene considerato uno standard sulla base di evidenze consolidate basate su studi osservazionali che hanno mostrato un calo della mortalità per neoplasie della portio in aree con elevata aderenza all’indagine. Poiché il virus del papilloma umano è l’agente etiologico di gran parte delle neoplasie, il test per l’HPV può essere associato al PAP test nello screening.
L’esame viene effettuato semplicemente analizzando un campione di cellule prelevate con una spatola (spatola di Ayre) ed un tampone nella zona di transizione tra endocervice ed esocervice, laddove si rilevano più frequentemente are displastiche e neoplastiche. Le cellule vengono classificate secondo il sistema di Bethesda (2001) Ogni anno si diagnosticano anormalità nel 6-7% dei campioni. La sensibilità del test varia dal 30% all’87% e la specificità dall’86 al 100%. Il Pap test è consigliato nelle donne in età fertile dai 21-25 ai 65 anni, anche se alcune linee guida lo raccomandano a partire da 3 anni dall’inizio dell’attività sessuale con cadenza triennale. Dai 35 aa è preferibile associare anche il test per HPV.
Lo screening si ferma a 65 aa per le donne che sono state seguite regolarmente e che non sono a rischio di carcinoma della cervice per altri motivi. Può essere considerato inutile per quelle che sono state sottoposte ad isterectomia totale (con rimozione della cervice) per cause benigne, mentre è opportuna una sorveglianza ventennale per chi ha un’anamnesi personale con storia di carcinoma della cervice e/o dell’utero. Anche i soggetti immunodepressi o con esposizione uterina al dietilstilbestrolo potrebbero richiedere un monitoraggio più frequente.
Per la prevenzione del carcinoma del colon retto esistono due modalità di screening: esame delle feci per la ricerca del sangue occulto ed esami endoscopici o radiologici. Il sangue occulto nelle feci andrebbe eseguito ogni 2 anni tra i 50 ed i 69 anni. È un test molto semplice ed abbastanza economico, che viene effettuato su 3 diversi campioni di feci. Consente di rilevare precocemente la comparsa di carcinomi o adenomi del colon retto. Se effettuato con il guaiaco ha una bassa specificità per cui richiede l’esecuzione di indagini endoscopiche aggiuntive. Recentemente con il test immunochimico la specificità è aumentata, ma il costo della metodica è più elevato, così come la ricerca del DNA (Fl-DNA) recentemente messa a punto da ricercatori italiani.
Qualora la ricerca del sangue occulto nelle feci sia positiva, si raccomanda l’esecuzione di un esame endoscopico con rettosigmoidoscopia che indaga i primi 60 cm di intestino e/o colonscopia completa se occorre una valutazione di tutto il colon.
Da qualche anno ha destato interesse anche la cosiddetta “colonscopia virtuale” che viene effettuata con tomografia computerizzata. Ha il vantaggio di evitare possibili complicanze endoscopiche come la perforazione o il sanguinamento, ma ha molte limitazioni. Infatti necessita di preparazione intestinale, non consente l’esecuzione della biopsia e si associa ad aumento del rischio cumulativo correlato all’esposizione a radiazioni che potrebbe diventare significativo se eseguita routinariamente nell’ambito di un programma di screening.
Altre modalità di prevenzione: i farmaci, i vaccini, la chirurgia
Dopo il capitolo degli screenings è doveroso affrontare quello della prevenzione attuato con farmaci e vaccini.
Per il carcinoma mammario femminile, sono disponibili due farmaci: tamoxifene e raloxifene, due modulatori selettivi del recettore estrogenico (SERMs), con attività estrogenica antagonista e parzialmente agonista. In uno studio il tamoxifene si è dimostrato efficace nel ridurre del 50% il rischio di tumori correlati al recettore estrogenico in donne in postmenopausa con età maggiore di 60 anni, anamnesi personale con storia di carcinoma lobulare in situ ed altri parametri (score di Gail). Malgrado il risultato, il farmaco può raddoppiare il rischio di carcinomi dell’endometrio e patologie cardiovascolari come trombosi venosa profonda o stroke.
In un altro studio i dati di efficacia sulla riduzione di mortalità non sono stati confermati, per cui il trattamento con tamoxifene non è al momento raccomandato per la prevenzione. Risultati migliori sono stati ottenuti con il raloxifene, che ha un profilo di tossicità con minori effetti collaterali. Per questo motivo la Food and Drug Administration (FDA) ne ha approvato l’uso con finalità preventiva nelle donne in postmenopausa.
Come per la mammella, anche per la prostata sembrano esserci due farmaci attivi nella prevenzione del carcinoma: finasteride e dutasteride, inibitori della 5-alfa reduttasi. In alcuni studi hanno dimostrato di ridurre del 25% l’insorgenza della neoplasia. I risultati inerenti la finasteride sono controversi sia per l’insorgenza nei soggetti trattati di tumori più aggressivi (score di Gleason maggiore di 6) sia per l’inefficacia sulla riduzione di mortalità, mentre ben noti sono gli effetti collaterali incluso la ginecomastia e la disfunzione sessuale. Qualche speranza in più sembra esserci con la dutasteride che ha dimostrato una riduzione dei tumori di circa il 23%, senza aumento di tumori aggressivi. Tuttavia ancora non sono disponibili dati definitivi.
Per quanto riguarda la prevenzione con i vaccini abbiamo già accennato in precedenza all’importanza del virus HPV, correlato allo sviluppo di molte neoplasie, ma soprattutto del carcinoma della cervice uterina, della vulva, dell’ano e del pene. Attualmente sono disponibili sia per le femmine che per i maschi un vaccino tetravalente, attivo contro il virus HPV 6,11,16 e 18, ed un vaccino nonavalente, attivo contro l’HPV 6,11,16,18,31,33,45,52 e 58. I ceppi 16 e 18 sono responsabili del 70% dei carcinomi della cervice uterina, mentre al 6 e l’11 sono ascrivibili il 90% dei condilomi genitali.
La vaccinazione è raccomandata dalla WHO per le adolescenti dai 9 ai 13aa ed in Italia è stata inserita nei LEA. In Italia la vaccinazione universale contro l’HPV per entrambi i sessi viene effettuata in 9 regioni. La vaccinazione può ridurre il rischio di neoplasia della cervice uterina fino al 90%, tuttavia non garantisce la copertura assoluta, per cui il Pap test è comunque indicato.
Al termine di questo excursus sulla prevenzione qualche cenno merita sicuramente la prevenzione chirurgica. Soggetti a rischio per caratteristiche ereditarie o genetiche possono infatti beneficiare della chirurgia. È il caso dei portatori di mutazione del gene BRCA per i quali possono essere indicate la mastectomia e la salpingo-annessiectomia profilattiche o per i portatori di poliposi adenomatosa familiare (FAP) per i quali è proposta la colectomia.
La mastectomia bilaterale profilattica nei portatori di mutazione di BRCA è efficace nel prevenire il 90% del tumore della mammella. La tecnica preferita è la mastectomia “skin –sparing” rispetto alla sottocutanea al fine di ridurre al minimo il tessuto mammario residuo, potenziale sede di neoplasia.
L’ovaro-annessiectomia profilattica stranamente trova maggiore spazio ed è praticata più frequentemente della mastectomia. Il motivo è da ricercare sia nella migliore compliance dei soggetti per i risvolti psicologici e sessuali di minore impatto sia nell’assenza di test di screening efficaci come la mammografia. Inizialmente è stata proposta solo per i soggetti con mutazione di BRCA 1-2, ma poi l’intervento è stato esteso anche alle donne con sindrome di Lynch e ad altre sindromi ereditarie. Nelle portatrici di mutazione di BRCA in premenopausa riduce il rischio di cancro dell’ovaio fino al 90-95% e di cancro della mammella fino al 50%; mentre nelle donne in postmenopausa è efficace esclusivamente nei confronti delle neoplasie ovariche. L’intervento andrebbe effettuato tra i 35 ed i 40 anni, dopo le gravidanze e può associarsi all’isterectomia, soprattutto nei casi di sindrome di Lynch dove il tumore dell’utero è più frequente.
La colectomia profilattica è indicata per i soggetti con FAP, che oltre a presentare centinaia o anche migliaia di polipi del colon, possono sviluppare carcinomi. Il tipo di intervento dipende dalle caratteristiche fenotipiche individuali e può prevedere una proctocolectomia totale con borsa ed anastomosi ileale o una colectomia addominale totale con ileo-rettoanastomosi, o proctocolectomia con ileostomia.
Oggi nuove prospettive si aprono nell’ambito della diagnosi precoce dei tumori con nuove modalità di intervento e nuovi test. Recentemente la rivista Science ha pubblicato un lavoro della John Hopkins University sulla cosiddetta” biopsia liquida”. I ricercatori hanno messo a punto un nuovo test, denominato CancerSEEK, basato su un semplice prelievo di sangue, che migliorerebbe la diagnosi di cancro. Il test consentirebbe di rilevare precocemente la presenza delle principali neoplasie (mammella, ovaio, fegato, stomaco, esofago, colon retto e polmone) prima che si sviluppino metastasi, con una specificità del 90%. La sensibilità è del 70%, per cui dovrà essere migliorato e non è ancora utile per uno screening. Tuttavia la strada è aperta ed il futuro offre nuovi sviluppi positivi.
La prevenzione in Italia
In Italia è stato implementato un sistema di sorveglianza nazionale, denominato PASSI, che indaga i fattori comportamentali di rischio per la salute e la diffusione degli interventi di prevenzione messi in campo dalle Aziende Sanitarie per la tutela del benessere dei cittadini con 18-69 anni.
PASSI fa parte delle strategie di contrasto e prevenzione messe in campo dal Ministero della Salute e dalle Regioni. Attivo dal 2007, PASSI raccoglie dati di continuo e per questo consente di rappresentare fenomeni nel tempo cogliendo le variazioni dei fattori di rischio o gli effetti delle azioni preventive. Quindi fornisce indicazioni utili sia alla progettazione delle azioni sia alla loro valutazione. Passi «permette di studiare l’evoluzione dei fenomeni nel tempo e rappresenta uno strumento importante per le finalità di governo centrale e locale di pianificazione, monitoraggio, valutazione degli interventi di prevenzione e promozione della salute», si legge in un comunicato.
Il convegno tenutosi a Roma il 9 gennaio 2018 per celebrare i 10 anni dall’istituzione del programma, rappresenta quindi un momento di riflessione sul tema delle sorveglianze di popolazione per promuovere l’uso dei dati, riflettere sui risultati raggiunti e sulle prospettive future. I dati PASSI mostrano chiaramente che le differenze per istruzione, condizioni economiche e cittadinanza nella partecipazione ai test di screening si riducono significativamente nell’ambito dei programmi organizzati e offerti dalle Aziende Sanitarie Locali rispetto a quanto si osserva nei dati sul ricorso al test di screening su iniziativa spontanea, ovvero fuori dai programmi organizzati.
Secondo PASSI in Italia fumano 10 milioni e mezzo di persone. I forti fumatori che fumano almeno 20 sigarette sono 2.350.000. Il fumo di tabacco, oggi in Italia, costituisce la prima causa evitabile di morte prematura.
Nella popolazione di 30 anni e più, il fumo provoca circa 80.000 morti l’anno: il 24% di tutti i decessi tra gli uomini e il 7% dei decessi tra le donne, con oltre 1.000.000 di anni di vita potenziale persi.
Secondo PASSI in Italia sono fisicamente attive (cioè raggiungono i livelli raccomandati oppure svolgono un lavoro che richiede sforzo fisico pesante) circa 20 milioni di persone tra i 18 ed i 69 anni. Le linee guida internazionali raccomandano per gli adulti almeno 150 minuti alla settimana di attività moderata o 75 di attività vigorosa o una combinazione delle due con esercizi di rafforzamento dei maggiori gruppi muscolari da svolgere almeno 2 volte alla settimana malattie cardio-vascolari casi di cancro al seno e al colon casi di diabete tipo II casi di morte prematura
Le diseguaglianze sociali sono quasi sempre correlate a differenze nello stato di salute e negli stili di vita. Avere maggiori disponibilità economiche e un livello di istruzione più alto, rende più facile condurre stili di vita sani e godere di una salute migliore. I dati PASSI mostrano che col diminuire del reddito disponibile e del livello di istruzione aumentano l’abitudine al fumo, la sedentarietà, l’obesità e si riduce l’attività fisica. Solo per il consumo a rischio di alcol non si nota questo gradiente. Le diseguaglianze sono presenti sia tra gli uomini che tra le donne e anche nei diversi gruppi di età.
Conclusioni
A tutt’oggi comunque l’educazione sanitaria resta il primo e fondamentale intervento ai fini di una prevenzione efficace. A tale proposito la Comunità Europea ha emanato dodici semplici regole a cui dovrebbe attenersi la popolazione generale, note come «Decalogo Europeo contro il cancro» (fig. 2).

A tale proposito si ricorda un preciso e puntuale intervento di Papa Francesco che in un Suo discorso ha detto:
Bibliografia
ABELOFF M. et al. , Clinical Oncology, 3th ed., «Elsevier Italia», 2004
AIOM, I numeri del cancro in Italia 2016, «Il Pensiero Scientifico», 2017
Cancer. Fact Sheet No 297. World Health Organization. Available at http://www.who.int/mediacentre/factsheets/fs297/en/. February 2015; Accessed: December 28, 2016
SIEGEL RL, MILLER KD, JEMAL A., Cancer statistics, 2016, «CA Cancer J Clin» 2016, Jan-Feb. 66 (1):7-30. [Medline]. [Full Text].
GAIL MH, BRINTON LA, BYA DP, CORLEe DK, GREEN SB, SCHAIRER C., Projecting individualized probabilities of developing breast cancer for white females who are being examined annually, «J Natl Cancer Inst», 1989, Dec 20. 81(24):1879-86. [Medline]
PLASKON LA, PENSON DF, VAUGHANTL, STANDFORD JL., Cigarette smoking and risk of prostate cancer in middle-aged men, «Cancer Epidemiol Biomarkers», Prev. 2003 Jul. 12(7):604-9. [Medline]
HHGHES JR, KEELY J, NAUD S., Shape of the relapse curve and long-term abstinence among untreated smokers, «Addiction» 2004, Jan. 99(1):29-38. [Medline]
ARMSTRONG BK, KRICKER A, The epidemiology of UV induced skin cancer, «J Photochem Photobiol B» 2001, Oct. 63(1-3):8-18. [Medline]
ROSSO S., ZANETTI R., MARTINEZ C., TORMO MJ, SCHRAUB S., SANCHO-GARNIER H., The multicentre south European study ‘Helios’. II: Different sun exposure patterns in the aetiology of basal cell and squamous cell carcinomas of the skin, «Br J Cancer» 1996, Jun. 73(11):1447-54. [Medline]
Sunbeds, tanning and UV exposure, World Health Organization (WHO), April 2010. Available at http://www.who.int/mediacentre/factsheets/fs287/en/print.html.
GREEN A., WILLIAMS G., NEALE R., HART V., LESLIE D., PARSONS P., Daily sunscreen application and betacarotene supplementation in prevention of basal-cell and squamous-cell carcinomas of the skin: a randomised controlled trial, «Lancet», 1999 Aug 28. 354(9180):723-9. [Medline]
HUNCHAREK M., KUPELNICK B., Use of topical sunscreens and the risk of malignant melanoma: a meta-analysis of 9067 patients from 11 case-control studies, «Am J Public Health» 2002, Jul. 92(7):1173-7. [Medline]
DENNIS LK, BEANE FREEMAN LE, VANBEEK MJ., Sunscreen use and the risk for melanoma: a quantitative review, «Ann Intern Med» 2003, Dec 16, 139(12):966-78. [Medline]
MARTÍNEZ ME, MARSHALLl JR, GIOVANUCCI E., Diet and cancer prevention: the roles of observation and experimentation, «Nat Rev Cancer» 2008, Sep. 8(9):694-703. [Medline].
KUSHI L., GIOVANNUCCI E., Dietary fat and cancer, « Am J Med» 2002, Dec 30. 113 Suppl 9B:63S-70S. [Medline]
GIOVANNUCCI E., RIMM EB, STAMPFER MJ, COLDITZ GA, ASCHERIO A, WILLETT WC, Intake of fat, meat, and fiber in relation to risk of colon cancer in men, «Cancer Res» 1994, May 1. 54(9):2390-7. [Medline]
WILLETT WC, STAMPFER MJ, COLDITZ GA, ROSNER BA, SPEIZER FE., Relation of meat, fat, and fiber intake to the risk of colon cancer in a prospective study among women, «N Engl J Med» 1990, Dec 13. 323(24):1664-72. [Medline]
NORA T., BINGHAM S., FERRARI P., SLIMANI N., JENAB M., MAZUIR M., Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition, «J Natl Cancer Inst» 2005, Jun 15. 97(12):906-16. [Medline].
CHAO A., THUN MJ, CONNELL CJ, MCCULLOUGH ML, JACOBS EJ, FLANDERS WD, Meat consumption and risk of colorectal cancer, «JAMA». 2005, Jan 12. 293(2):172-82. [Medline]
KUSHI LH, DOYLE C, MC CULLOUGH M., ROCK CL, DEMARK-WAHNEFRIED W., BANDERA EV et al., American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity, «CA Cancer J Clin» 2012, Jan-Feb. 62(1):30-67. [Medline]
FESKANICH D., ZIEGLER RG, MICHAUD DS, GIOVANNUCCI EL, SPEIZER FE, WILLETT WC., Prospective study of fruit and vegetable consumption and risk of lung cancer among men and women, « J Natl Cancer Inst» 2000, Nov 15. 92(22):1812-23. [Medline]
KOUSHIK A., HUNTER DJ, SPIEGELMAN D., BEESON WL, VAN DEN BRANDT PA, Buring JE. Fruits, vegetables, and colon cancer risk in a pooled analysis of 14 cohort studies, «J Natl Cancer Inst» 2007, Oct 3. 99(19):1471-83. [Medline]
BINGHAM SA, DAY NE, LUBEN R., FERRARI P., SLIMANI N., NORAT T., Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study, «Lancet» 2003, May 3. 361(9368):1496-501. [Medline]
KUSHI LH, BYERS T., DOYLE C, BANDERA EV, MC CULLOUGH M., MC TIERNAN A., American Cancer Society Guidelines on Nutrition and Physical Activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity, «CA Cancer J Clin» 2006, Sep-Oct. 56(5):254-81; quiz 313-4. [Medline]
HARVARD REPORT ON CANCER PREVENTION, v. 1, Causes of human cancer, «Cancer Causes Control» 1996, Nov. 7 Suppl 1:S3-59. [Medline]
COLDITZ GA, CANNUSCIO CC, FRAZIER AL., Physical activity and reduced risk of colon cancer: implications for prevention, «Cancer Causes Control» 1997, Jul. 8(4):649-67. [Medline]
CALLE EE, RODRIGUEZ C., WALKER-THURMOND K., THUN MJ., Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults, «N Engl J Med» 2003, Apr 24. 348(17):1625-38. [Medline]
WEIGHT CONTROLL AND PHYSICAL ACTIVITY (6) 2002
ADAMS TD, GRESS RE, SMITH SC, HALVERSON RC, SIMPER SC, ROSAMOND WD, Long-term mortality after gastric bypass surgery, «N Engl J. Med» 2007, Aug 23. 357(8):753-61. [Medline]
WONG O., WHORTON MD, FOLIART DE, LOWENGART R., An ecologic study of skin cancer and environmental arsenic exposure, «Int Arch Occup Environ Health» 1992, 64(4):235-41. [Medline]
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, Preamble 2006
CHANG MH, Prevention of hepatitis B virus infection and liver cancer, «Recent Results Cancer Res» 2014, 193:75-95. [Medline]
SUGIMOTO K., KIM SR, KIM SK, IMOTO S., TOHYAMA M., Kim KI et al., Comparison of Daclatasvir and Asunaprevir for Chronic HCV 1b Infection with Telaprevir and Simeprevir plus Peginterferon and Ribavirin, with a Focus on the Prevention of Occurrence and Recurrence of Hepatocellular Carcinoma, «Oncology» 2015, Nov. 89 Suppl 2:42-46. [Medline]
OZOYA OO, SOKOL L., DALIA S., EBV-related Malignancies, Outcomes and Novel Prevention Strategies., «Infect Disord Drug Targets» 2015, Nov 19. [Medline]
BUSCH MP, GLYNN SA, STRAMER SL, STRONG DM, CAGLIOTTI S., WRIGHT DJ et al., A new strategy for estimating risks of transfusion-transmitted viral infections based on rates of detection of recently infectLittle RF. AIDS-related non-Hodgkin’s lymphoma: etiology, epidemiology, and impact of highly active antiretroviral therapy, «Leuk Lymphoma» 2003, 44 Suppl 3:S63-8. [Medline]
SUNG JJ, TSOI KK, WONG VW, LI KC, CHAN HL., Meta-analysis: Treatment of hepatitis B infection reduces risk of hepatocellular carcinoma, «Aliment Pharmacol Ther» 2008, Nov 1. 28(9):1067-77. [Medline]
UEMURA N., MUKAI T., OKAMOTO S., YAMAGUCHI S., MASHIBAH., TANIYAMA K., Effect of Helicobacter pylori eradication on subsequent development of cancer after endoscopic resection of early gastric cancer, «Cancer Epidemiol Biomarkers Prev» 1997, Aug. 6(8):639-42. [Medline]
SAITO K., ARAI K, MORI M., KOBAYASHI R., OHKI I., Effect of Helicobacter pylori eradication on malignant transformation of gastric adenoma, «Gastrointest Endosc» 2000, Jul. 52(1):27-32. [Medline]
WONG BC, LAM SK, WONG WM, CHEN JS, ZHENG TT, FENG RE, Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial, «JAMA» 2004, Jan 14. 291(2):187-94. [Medline]
THOMAS DB, GAO DL, RAY RM, WANG WW, Allison CJ, Chen FL. Randomized trial of breast self-examination in Shanghai: final results, «Natl Cancer Inst» 2002, Oct 2. 94(19):1445-57. [Medline]
BAXTER N., Preventive health care, 2001 update: should women be routinely taught breast self-examination to screen for breast cancer?, «CMAJ» 2001, Jun 26. 164(13):1837-46. [Medline]. [Full Text].
HARVEY BJ, MILLER AB, BAINES CJ, COREY PN., Effect of breast self-examination techniques on the risk of death from breast cancer, «CMAJ» 1997, Nov 1. 157(9):1205-12. [Medline]
NEWCOME PA, WEISS NS, STORER BE, SCHOLES D, YOUNG BE, VOIGT LF., Breast self-examination in relation to the occurrence of advanced breast cancer, « J Natl Cancer Inst» 1991, Feb 20. 83(4):260-5. [Medline]
WOOLF SH, The 2009 breast cancer screening recommendations of the US Preventive Services Task Force, «JAMA» 2010, Jan 13. 303(2):162-3. [Medline]
[Guideline] OEFFINGER KC, FONTHAM ET, ETZIONI R. et al, American Cancer Society. Breast Cancer Screening for Women at Average Risk: 2015 Guideline Update From the American Cancer Society, « JAMA» 2015 Oct 20. 314 (15):1599-614. [Medline]. [Full Text].
CHIARELLI AM, MAJPRUZ V, BROWN P, THÉRIAULT M., SHUMAK R., MAI V., The contribution of clinical breast examination to the accuracy of breast screening, «J Natl Cancer Inst» 2009, Sep 16. 101(18):1236-43. [Medline]
BOBO JK, LEE NC, THAMES SF, Findings from 752,081 clinical breast examinations reported to a national screening program from 1995 through 1998, « J Natl Cancer Inst» 2000, Jun 21. 92(12):971-6. [Medline]
BERRY DA, CRONIN KA, PLEVRITIS SK, FRYBACK DG, CLARKE L., ZELEN M., Effect of screening and adjuvant therapy on mortality from breast cancer, «N Engl J Med» 2005, Oct 27. 353(17):1784-92. [Medline]
GØTZSCHE PC, NIELSEN M., Screening for breast cancer with mammography, «Cochrane Database Syst Rev» 2006, Oct 18. CD001877. [Medline]
SKAANE P., HOFVIND S., SKJENNALD A., Randomized trial of screen-film versus full-field digital mammography with soft-copy reading in population-based screening program: follow-up and final results of Oslo II study, «Radiology» 2007, Sep. 244(3):708-17. [Medline]
Recommendations on cancer screening in the European union. Advisory Committee on Cancer Prevention, «Eur J Cancer» 2000, Aug. 36(12):1473-8. [Medline]
WOLOSHIN S., SCWARTZ LM, The benefits and harms of mammography screening: understanding the trade-offs, «JAMA» 2010, Jan 13. 303(2):164-5. [Medline]
BERG WA, Benefits of screening mammography, «JAMA» 2010, Jan 13. 303(2):168-9. [Medline]
VAN DIJCK JA, VERBEEK AL, BEEX LV, HENDRIKS JH, HOLLAND R., MRAVUNAC M., Mammographic screening after the age of 65 years: evidence for a reduction in breast cancer mortality, «Int J Cancer» 1996, Jun 11. 66(6):727-31. [Medline]
SCHONBERG MA, SILLIMAN RA, MARCANTONIO ER., Weighing the benefits and burdens of mammography screening among women age 80 years or older, «J Clin Oncol» 2009, Apr 10. 27(11):1774-80. [Medline]. [Full Text].
MANDELBLATT J., SAHA S., TEUTSCH S. et al., The cost-effectiveness of screening mammography beyond age 65 years: a systematic review for the U.S. Preventive Services Task Force, «Ann Intern Med» 2003, Nov 18. 139(10):835-42. [Medline]
KERLIKOWSKE K., SALZMANN P., PHILLIPS KA, CAULEY JA, Cummings SR. Continuing screening mammography in women aged 70 to 79 years: impact on life expectancy and cost-effectiveness, «JAMA» 1999, Dec 8. 282(22):2156-63. [Medline]
ANDRIEU N., EASTON DF, CHANG-CLUADE J., ROOKUS MA, BROTHER R., CARDIS E., Effect of chest X-rays on the risk of breast cancer among BRCA1/2 mutation carriers in the international BRCA1/2 carrier cohort study: a report from the EMBRACE, GENEPSO, GEO-HEBON, and IBCCS Collaborators’ Group, «J Clin Oncol» 2006, Jul 20. 24(21):3361-6. [Medline]
NAROD SA, LUBINSKI J., GHADIRIAN P., LYNCH HT, MOLLER P, FOULKES WD, Screening mammography and risk of breast cancer in BRCA1 and BRCA2 mutation carriers: a case-control study, «Lancet Oncol» 2006, May. 7(5):402-6. [Medline]
WARNER E., PLEWES DB, HILL KA, CAUSER PA, ZUBOVITS JT, JONG RA, Surveillance of BRCA1 and BRCA2 mutation carriers with magnetic resonance imaging, ultrasound, mammography, and clinical breast examination, «JAMA» 2004, Sep 15. 292(11):1317-25. [Medline]
KRIEGHE M., BREKELMANS CT, BOETES C., BESNARD PE, ZONDERLAND HM, OBDEIJN IM, Efficacy of MRI and mammography for breast-cancer screening in women with a familial or genetic predisposition, «N Engl J Med» 2004, Jul 29. 351(5):427-37. [Medline]
WARNER E., MESSERSMITH H., CAUSER P., EISEN A., SHUMAK R., Plewes D. Systematic review: using magnetic resonance imaging to screen women at high risk for breast cancer, «Ann Intern Med» 2008, May 6. 148(9):671-9. [Medline]
LEHMAN CD, BLUME JD, WEATHERALL P., THICKMAN D., HYLTON N., WARNER E., Screening women at high risk for breast cancer with mammography and magnetic resonance imaging, «Cancer» 2005, May 1. 103(9):1898-905. [Medline]
SASLOW D., BOETESE C., BURKE W., HARMS S., LEACH MO, LEHMAN CD, American Cancer Society guidelines for breast screening with MRI as an adjunct to mammography, «CA Cancer J Clin» 2007, Mar-Apr. 57(2):75-89. [Medline]
NATIONAL INSTITUTE OF HEALTH AND CLINICAL EXCELLENCE. FAMILIAL BREAST CANCER. Available at http://www.nice.org.uk/nicemedia/pdf/CG41NICEguidance.pdf, Accessed: Feb 10, 2010
Cervical cancer screening programs. I. Epidemiology and natural history of carcinoma of the cervix, «Can Med Assoc J» 1976, Jun 5. 114(11):1003-12. [Medline]
CANNISTRA SA, NILOFF JM., Cancer of the uterine cervix, «N Engl J Med» 1996, Apr 18. 334(16):1030-8. [Medline]
NIEMINEM P., KALLIO M., HAKAMA M., The effect of mass screening on incidence and mortality of squamous and adenocarcinoma of cervix uteri, «Obstet Gynecol» 1995, Jun. 85(6):1017-21. [Medline]
NOORANI HZ, BROWN A., SKIDMORE B., STUART GC., Liquid-based cytology and human papillomavirus testing in cervical cancer screening, Technology report no 40. 2003
KARNON J., PETERS J., PLATT J., CHILCOTT J., MCGOOGANE., BREWER N., Liquid-based cytology in cervical screening: an updated rapid and systematic review and economic analysis, «Health Technol Assess» 2004 May, 8(20):iii, 1-78. [Medline.
SOLOMON D., PAPILLO JL, DAVEY DD, Statement on human papillomavirus DNA test utilization, «Cancer Cytopathol» 2009, Jun 25. 117(3):154-6. [Medline]
[Guideline] SASLOW D. et al; ACS-ASCCP-ASCP Cervical Cancer Guideline Committee. American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer, «CA Cancer J Clin» 2012, May-Jun. 62 (3):147-72. [Medline]. [Full Text]
ACOG Practice Bulletin: clinical management guidelines for obstetrician-gynecologists, Number 45, August 2003. Cervical cytology screening (replaces committee opinion 152, March 1995), «Obstet Gynecol» 2003, Aug. 102(2):417-27. [Medline]
[Guideline] MOYER VA, U.S. Preventive Services Task Force. Screening for cervical cancer: U.S. Preventive Services Task Force recommendation statement, «Ann Intern Med» 2012, Jun 19. 156 (12):880-91, W312. [Medline]. [Full Text]
LEVIN B., LIBERMAN DA, MCFARLAND B., SMITH RA, BROOKS D., ANDREWS KS, Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008: a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer, and the American College of Radiology, «CA Cancer J Clin» 2008, May-Jun. 58(3):130-60. [Medline]
MANDEL JS, CHURCH TR, EDERER F., BOND JH, Colorectal cancer mortality: effectiveness of biennial screening for fecal occult blood., «J Natl Cancer Inst» 1999, Mar 3. 91(5):434-7. [Medline]
NEWCOMB PA, NORFLEET RG, STORER BE, SURAWICZ TS, MARCUS PM, Screening sigmoidoscopy and colorectal cancer mortality, «J Natl Cancer Inst» 1992, Oct 21. 84(20):1572-5. [Medline]
REX DK, JOHNSON DA, ANDERSON JC, SCHOENFELD PS, BURKE CA, INADOMI J, American College of Gastroenterology guidelines for colorectal cancer screening 2009 [corrected], «Am J Gastroenterol» 2009, Mar. 104(3):739-50. [Medline]
SCHORGE JO, HOSSEIN SABOORIAN M., HYNAN L., ASHFAQ R., ThinPrep detection of cervical and endometrial adenocarcinoma: a retrospective cohort study, «Cancer» 2002, Dec 25. 96(6):338-43. [Medline]
DOVE-EDWIN I., BOKS D., GOFF S., KENTER GG, CARPENTRE R., VASEN HF, The outcome of endometrial carcinoma surveillance by ultrasound scan in women at risk of hereditary nonpolyposis colorectal carcinoma and familial colorectal carcinoma, «Cancer» 2002, Mar 15. 94(6):1708-12. [Medline]
[Guideline] WENDER R., FONTHAM ET, BARRERA E. jR, COLDITZ GA, CHURCH TR, ETTINGER DS et al., American Cancer Society lung cancer screening guidelines, «CA Cancer J Clin» 2013, Mar-Apr. 63 (2):107-17. [Medline]
[Guideline] DETTERBECK FC, MAZZONE PJ, NAIDICH DP, BACH PB, Screening for lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines, «Chest» 2013, May. 143 (5 Suppl):e78S-92S. [Medline].
[Guideline] MOYER VA, U.S. Preventive Services Task Force. Screening for ovarian cancer: U.S. Preventive Services Task Force reaffirmation recommendation statement, «Ann Intern Med» 2012, Dec 18. 157 (12):900-4. [Medline]. [Full Text]
[Guideline] American College of Obstetricians and Gynecologists Committee on Gynecologic Practice. Committee Opinion No. 477: the role of the obstetrician-gynecologist in the early detection of epithelial ovarian cancer, «Obstet Gynecol» 2011, Mar. 117 (3):742-6. [Medline]. [Full Text].
Guideline] GENETIC/FAMILIAL HIGH-RISK ASSESSMENT: BREAST AND OVARIAN: VERSION 2.2015. National Comprehensive Cancer Network. Available at http://www.nccn.org/professionals/physician gis/PDF/genetics screening.pdf. Accessed: November 27, 2015
SCHRODER FH, HUGOSSONJ., ROOBOL MJ, TAMMELA TL, CIATTO S., NELEN V., Screening and prostate-cancer mortality in a randomized European study, «N Engl J Med» 2009, Mar 26. 360(13):1320-8. [Medline]
GUESS HA,HYESE JF, GORMLEY GJ, The effect of finasteride on prostate-specific antigen in men with benign prostatic hyperplasia, «Prostate» 1993,. 22(1):31-7. [Medline]
ROEHRBORN CG, MARKS LS, FENTER T., FREEDMAN S., TUTTLE J., GITTLEMAN M., Efficacy and safety of dutasteride in the four-year treatment of men with benign prostatic hyperplasia, «Urology» 2004, Apr. 63(4):709-15. [Medline]
FISHER B., COSTANTINO JP, WICKERHAM DL, REDMOND CK, KAVANAH M., CRONIN WM, Tamoxifen for prevention of breast cancer: report of the National Surgical Adjuvant Breast and Bowel Project P-1 Study, «J Natl Cancer Inst» 1998, Sep 16. 90(18):1371-88. [Medline]
FISHER B., COSTANTINO JP, WICKERHAM DL et al, Tamoxifen for the prevention of breast cancer: current status of the National Surgical Adjuvant Breast and Bowel Project P-1 study, «J Natl Cancer Inst» 2005, Nov 16. 97(22):1652-62. [Medline]
CUZICK J., FORBES J, EDWARDS R., BAUM M, CAWTHORN S., COATES A., First results from the International Breast Cancer Intervention Study (IBIS-I): a randomised prevention trial, «Lancet» 2002, Sep 14. 360(9336):817-24. [Medline]
CUZICK J., POWLES T., VERONESI U., FORBES J., EDWARDS R., ASHLEY S., Overview of the main outcomes in breast-cancer prevention trials, «Lancet» 2003, Jan 25. 361(9354):296-300. [Medline]
CHEMOPREVENTION FO BREAST CANCER (2002), U.S. Preventive Services Task Force. Available at http://www.uspreventiveservicestaskforce.org/uspstf/uspsbrpv.htm, Accessed: Feb 10, 2010
VOGEL VG, COSTANTINO JP, WICKERHAM DL, CRONIN WM, CECCHINI RS, ATKINS JN, Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 trial, «JAMA» 2006, Jun 21. 295(23):2727-41. [Medline]
VILLA LL, COSTA RL, PETTA CA, ANDRADE RP, AULT KA, GIULIANO AR, Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial, «Lancet Oncol» 2005, May. 6(5):271-8. [Medline]
MARKOWITZ LE, DUNNE EF, SARAIYA M., CHESSON HW, CURTIS CR, GEE J. et al., Human papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP), «MMWR Recomm Rep» 2014, Aug 29. 63 (RR-05):1-30. [Medline]. [Full Text]
HARPER DM, FRANCO EL, WHELLER C. et al., Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial, «Lancet» 2004, Nov 13-19. 364(9447):1757-65. [Medline]
SLADE BA, LEIDEL L., VELLOZZI C, WOO EJ, HUA W., SUTHERLAND A., Postlicensure safety surveillance for quadrivalent human papillomavirus recombinant vaccine, «JAMA» 2009, Aug 19. 302(7):750-7. [Medline]
SASSLOW D., ANDREWS KS, MANASSARAM-BAPTISTE D., LOOMER L., LAM KE, FISHER-BORNE M., et al., Human papillomavirus vaccination guideline update: American Cancer Society guideline endorsement, «CA Cancer J Clin» 2016, Sep. 66 (5):375-85. [Medline]. [Full Text]
ACOG Committee Opinion No. 344: Human papillomavirus vaccination, «Obstet Gynecol» 2006, Sep. 108(3 Pt 1):699-705. [Medline]
PARRY J., Vaccinating against cervical cancer, «Bull World Health Organ» 2007, Feb. 85(2):89-90. [Medline]. [Full Text]
REBBECK TR, FRIEBEL T, LYNCH HT, NEUHAUSEN SL, VAN ‘T VEER L., GARBER JE, Bilateral prophylactic mastectomy reduces breast cancer risk in BRCA1 and BRCA2 mutation carriers: the PROSE Study Group, «J Clin Oncol» 2004, Mar 15. 22(6):1055-62. [Medline]
HARTMANN LC, SCHAID DJ, WOODS JE, CROTTY TP, MYEERS JL, ARNOLD PG, Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer, « N Engl J Med» 1999, Jan 14. 340(2):77-84. [Medline]
HARTMANN LC, SELLERS TA, SCHAID DJ, FRANCK TS, SODERBERG CL, SITTA DL, Efficacy of bilateral prophylactic mastectomy in BRCA1 and BRCA2 gene mutation carriers, «J Natl Cancer Inst» 2001, Nov 7. 93(21):1633-7. [Medline]
MEIJERS-HEIJBOER H., VAN GEEL B., VAN PUTTEN WL, HENZE-LOGMANS SC, SEYNAEVE C., MENKE-PLUYMERS MB, Breast cancer after prophylactic bilateral mastectomy in women with a BRCA1 or BRCA2 mutation, «N Engl J Med» 2001, Jul 19. 345(3):159-64. [Medline]
HARTMANN LC, DEGNIM A., SCHAID DJ, Prophylactic mastectomy for BRCA1/2 carriers: progress and more questions, « J Clin Oncol» 2004, Mar 15. 22(6):981-3. [Medline]
GUILLEM JG, WOOD WC, MOLEY JF, BERCHUK A., KARLAN BY, MUTCH DG, ASCO/SSO review of current role of risk-reducing surgery in common hereditary cancer syndromes, « J Clin Oncol» 2006, Oct 1. 24(28):4642-60. [Medline]
REBBECK TR, LYNCH HT, NEUHAUSEN SL, NAROD SA, VAN’TVEER L., GARBER JE, Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations, « N Engl J Med» 2002, May 23. 346(21):1616-22. [Medline]
KAUFF ND, SATAGOPAN JM, ROBOSON ME, SCHEUER L., HENSLEY M., HUDIS CA, Risk-reducing salpingo-oophorectomy in women with a BRCA1 or BRCA2 mutation, «N Engl J Med» 2002, May 23. 346(21):1609-15. [Medline]
METCALFE K., LYNCH HT, GHADIRIAN P., TUNG N., OLIVOTTO I., WARNER E., Contralateral breast cancer in BRCA1 and BRCA2 mutation carriers, «J Clin Oncol» 2004, Jun 15. 22(12):2328-35. [Medline]
EISEN A., LUBINSKI J., KLIJN J., MOLLER ., LYNCH HT, OFFIT K, Breast cancer risk following bilateral oophorectomy in BRCA1 and BRCA2 mutation carriers: an international case-control study, « J Clin Oncol» 2005, Oct 20. 23(30):7491-6. [Medline]
REBBECK TR, LEVIN AM, EISEN A., SNYDER C., WATSON P., CANNON-ALBRIGHT L., Breast cancer risk after bilateral prophylactic oophorectomy in BRCA1 mutation carriers, « J Natl Cancer Inst» 1999, Sep 1. 91(17):1475-9. [Medline]
OLIVIER RI, VAN BEURDEN M., LUBSEN MA, ROOKUS MA, MOOIJ TM, VAN DE VIJVER MI, Clinical outcome of prophylactic oophorectomy in BRCA1/BRCA2 mutation carriers and events during follow-up, «Br J Cancer» 2004, Apr 19. 90(8):1492-7. [Medline]
FINCH A., BEINER M., LUBINSKI J., LYNCH HT, MOLLER P., ROSEN B., Salpingo-oophorectomy and the risk of ovarian, fallopian tube, and peritoneal cancers in women with a BRCA1 or BRCA2 Mutation, «JAMA» 2006, Jul 12. 296(2):185-92. [Medline]
SCHMELER KM, LYNCH HT, CHEN LM, MUNSELL MF, SOLIMAN PT, CLARK MB, Prophylactic surgery to reduce the risk of gynecologic cancers in the Lynch syndrome, «N Engl J Med» 2006, Jan 19. 354(3):261-9. [Medline]
GUILLEM JG, WOOD WC, MOLEY IF, BERCHUCK A., KARLAN BY, MUTCH DG, ASCO/SSO review of current role of risk-reducing surgery in common hereditary cancer syndromes, «J Clin Oncol» 2006, Oct 1. 24(28):4642-60. [Medline]
ATTO DEL CONVEGNO NAZIONALE PASSI 2018, schede tematiche: http://www.epicentro.iss.it/passi/incontri/PassiLunghi10anni.asp
IARC Publication, Cancer Epidemiology: Principles and Methods, ed. I. Dos Santos Silva
CODICE EUROPEO CONTRO IL CANCRO: http://cancer-codeeurope.iarc.fr
© Bioetica News Torino, Giugno 2018 - Riproduzione Vietata