Vita prenatale: inizio di un viaggio
Dall’embrione all’adulto: aspetti biologici e dati scientifici1
di Clementina Peris*
Abstract
La teoria dell’ “Origine della Salute e della Malattia in fase di Sviluppo” è nata da studi epidemiologici negli anni ’90 ed è oggi accreditata dagli studi di epigenetica, che vanno oltre al determinismo genetico e indicano nella maturazione dei gameti, nelle condizioni di vita intrauterine dell’embrione e del feto l’impostazione di un fenotipo futuro che evolverà secondo linee di maggior salute o malattia. L’epigenetica, cioè lo studio dell’impostazione di lettura del DNA, studia anche la plasticità residuale dell’individuo dopo la nascita, cioè la possibilità di evolvere lungo linee di maggior salute attraverso adeguate cure postnatali e stili di vita promuoventi la salute fisica e psichica. Per ragioni di tipo epigenetico risultano particolarmente preoccupanti le tecniche di riproduzione assistita che coinvolgono modificazioni dell’assetto epigenetico degli embrioni, coltivati in vitro, dato che non è assolutamente studiata a fondo e chiarita la ricaduta sulla salute futura dei nati.
Il professor Giorgio Palestro ha già esposto i concetti di genetica e di epigenetica. Mi soffermo solo a sottolineare come a un genotipo (assetto genetico) possano corrispondere diverse espressioni fenotipiche (assetto epigenetico), perché nel viaggio della vita prenatale, quindi postnatale, è cruciale per l’impostazione del programma non solo come si parte (con quale patrimonio genetico), ma soprattutto come (con quale impostazione epigenetica) si arriva, ovvero quale e quanta parte del Dna è letto e tradotto in informazioni utilizzate.
Oggi possiamo dire che una buona parte di un sano invecchiamento comincia nell’utero.
Già vent’anni fa studi epidemiologici sull’incidenza di malattie croniche in varie parti del mondo correlarono il basso peso alla nascita con una maggiore incidenza di patologie metaboliche – malattie cardiovascolari, ipertensione, diabete tipo 2 da adulti – (BARKER D.J, Intrauterine programming of adult disease, in «Medicine Today Today» 1995:418-23), attribuendole ad una risposta programmata in seguito a malnutrizione intrauterina. Precedentemente non vi era evidenza che il nascere di basso peso fosse legato ad un problema di salute futura. A quei tempi non si pensava proprio che il nascere di basso peso alla nascita fosse legato ad un problema di salute futura.
Si propose quindi un’ipotesi detta dell’”Origine della salute e della malattia durante la fase dello sviluppo”, secondo la quale l’embrione e il feto a fronte di regime nutrizionale insufficiente, pur di sopravvivere, si adeguavano all’ambiente attraverso modificazioni epigenetiche adattive. Impostato in utero ad un’economia di risparmio energetico, in età adulta ogni individuo a fronte di un apporto nutrizionale in eccesso sarebbe andato incontro all’obesità e con questa a patologie coronariche (BARKER D.J., CLARK P.M., Developmental origins of health and diseases, in «Rev. Reprod.» 1997; 2: 105-11).
L’ipotesi epidemiologica della salute e della malattia con origine nella nostra vita intrauterina è stata ora accolta come teoria, avvalorata dagli studi di epigenetica (WATERLAND R.A.,MICHELS K.B., Epigenetic epidemiology of the developmental origins hypothesis, «Annu. Rev. Nutr.» 2007; 27: 363-88). Nel deficit di crescita intrauterino (IUGR) il feto ridistribuisce le scarse risorse privilegiando i tessuti nobili – il cervello, le surrenali, il cuore – risparmiando sulla crescita degli altri organi e tessuti. Il feto esita in particolare in una minore massa muscolare e in una maggiore quota di adipe che persisterà fino alla vita adulta, comportando una diminuita sensibilità all’insulina e un aumento degli indici di infiammazione. Questi sono meccanismi di tipo epigenetico.
Oggi si arriva ad affermare che studiando lo stato di una placenta alla nascita possiamo predire il futuro benessere o meno metabolico e cardiovascolare per tutta la vita (THORNBURG K.L. e al. 2010; COUZIN-FRANKEL J. 2013, LAKSHMY R. 2013).
Innanzitutto perché il feto adotta un unico tipo di risposta allo stress sia che si tratti di un insulto nutrizionale in eccesso sia in difetto di macronutrienti; poi perché tutti i nati sono espressione della madre, cioè l’ambiente da cui trae origine (prima come oocita) e nutrimento (poi come embrione e feto). Ad esempio in caso di stato pro- infiammatorio della madre, come risposta a stato metabolico inadeguato, il cuore del feto ha meno miociti (ma possono essere più larghi), se il rene ha meno nefroni, c’è minor quota di muscolo scheletrico, il pancreas ha meno β cellule e gli adipociti sono più larghi.
Tuttavia non dobbiamo pensare che proprio tutto sia già definito a priori, abbiamo anche una certa plasticità epigenetica successiva, possiamo incidere su alcune istruzioni di lettura del DNA, andando ad inibire marcatori epigenetici dannosi con uno stile di vita adeguato e con una dieta ricca di fotocomposti naturali benefici.
Il problema è però il timing di un insulto nutrizionale. Se l’insulto nutrizionale insorgerà nel periodo di maturazione dell’ovocita, nei primi stadi di vita dell’embrione, avrà un maggiore impatto sulla condizione epigenetica globale, perché tale condizione continuerà ad essere trasmessa lungo ripetute divisioni mitotiche fino alle successive cellule staminali, somatiche e germinali, a differenza di un insulto che avvenga più tardi nelle successive fasi di sviluppo.
Considerare dunque il peso alla nascita come indice di adeguatezza placentare.
Possiamo affermare che se si è in presenza di un basso peso alla nascita è perché si era precedentemente manifestata inadeguatezza placentare nel sostenere una buona gravidanza che predispone in seguito a malattia dismetabolica (THOMPSON J.A. e REGNAULT T.R., 2011; LAKSHMY R. 2013).
Nel mondo si stima il 9,55% dei nati a termine sia di basso peso (meno di 2500 gr.) e l’1,2% di peso molto basso (meno di 1500 gr.), la maggior parte dei quali nasce nei paesi in via di sviluppo dove non c’è apporto nutrizionale adeguato per molte madri (UNICEF, WHO, Report 2004).
Paradossalmente anche nella realtà del mondo occidentale i nati sottopeso continuano ad aumentare, soprattutto per il ricorso alla PMA (Procreazione Medicalmente Assistita) (incidono infatti per il 26% nelle gravidanze da PMA) e alla gravidanza in età avanzata; questi due fattori, come noto, comportano problemi vascolari placentari.
Per la salute delle future generazioni occorrerà allora individuare nuovi (o piuttosto riprendere in mano alcuni ritenuti obsoleti) interventi terapeutici, per prevenire il danno dismetabolico insito nel basso peso alla nascita a seguito di inadeguatezza placentare.
Il processo dell’infiammazione è utilissimo al nostro corpo, perché oltre a intervenire in processi patologici importanti, quali la difesa da agenti patogeni, è alla base anche dei processi fisiologici quali la regolazione del metabolismo e la riproduzione. La funzione riproduttiva per realizzarsi pienamente e con esito in salute di madre e neonato necessita di uno stato infiammatorio ben sincronizzato e controllato che si realizza appieno solo in condizioni ovviamente permittenti (cioè che l’oocita e lo spermatozoo si possano incontrare) sia in utero che in vitro, ma sempre in presenza di un adeguato apporto nutrizionale.
Uno stato nutrizionale inadeguato in fase preconcezionale, periconcezionale, in gravidanza e allattamento può arrivare a compromettere attraverso modificazioni di tipo epigenetico il DNA, queste alterazioni possono essere trasmesse, come è stato già evidenziato, alle generazioni future (figli e nipoti fino alla terza generazione) anche attraverso la linea germinale e predispongono una serie di patologie cardiovascolari, diabete, asma, allergie, diabete di tipo 2, ma anche depressione, alterazioni comportamentali. Tutto ciò si verifica in risposta a uno stato infiammatorio non adeguato al processo riproduttivo nelle sue varie fasi.
Guardiamo all’alimentazione. Se si attua una dieta ricca in grassi o è presente un eccesso di trigliceridi circolanti (condizione presente sia nel sovrappeso che nel sottopeso) l’ooocita viene danneggiato dall’accumulo di grassi al suo interno. Ne risulta che i bambini che nascono portano dentro di sé la codifica per un maggior rischio infiammatorio e sono ben predisposti all’obesità. Pertanto vediamo come il danno passa dall’ooocita all’embrione, alla placenta, al feto, al neonato e infine all’adulto.
Una dieta ricca in grassi può portare a patologie della gravidanza: una maggiore incidenza di aneuploidia degli oociti (può conseguire un aborto); anomalie epigenetiche degli embrioni (tali da causare un aborto); ritardo di crescita fetale e anomalie di sviluppo del cervello. Tutto ciò, in base a esperimenti di transfer embrionario, non è dovuto all’ambiente endouterino, ma a difetti che insorgono prima dello stadio di blastocisti (LUZZO K.M. e al. 2012).
Invece una carenza proteica o di arginina o di acidi grassi omega 3 può predisporre verso un maggior rischio di asma (REBELATO H.J. e al. 2013; WU G. e al. 2013; JONES M.L. e al. 2013; PIKE K.C., e al. 2014) mentre una dieta ricca in grassi e zuccheri altera anche i meccanismi di ricompensa a livello mesolimbico (ONG ZY e al. 2011), determinando una maggior difficoltà al mantenimento di un peso adeguato.
Una malnutrizione materna (MM) può compromettere non solo la riproduzione personale, ma anche quella delle proprie figlie, comportando modificazioni epigenetiche tali da creare una riserva ovarica ridotta nella neonata (HALLOWS S.E. e al. 2012).
Non solo un bilancio energetico negativo o in eccesso, ma anche un apporto inadeguato di micronutrienti costituisce un danno alla competenza dell’oocita e dell’embrione. Oggi supportiamo con l’acido folico la fase preconcezionale e le gravidanze, perché una carenza prima della gravidanza può determinare problemi di tipo riproduttivo, anche malformativo durante la fase dell’organogenesi.
Si è riscontrato che proprio attraverso alterazioni del metabolismo dell’acido folico possono insorgere alterazioni epigenetiche nei nati da fertilizzazioni in vitro (STEEGERS-THEUNISSEN R.P.M. e al., The periconceptional period, reproduction and long-term health of offspring. The importance of one –carbon metabolism («Hum Reprod. Update» 2013, 19: 640-655), tanto che gli autori concludono sottolineando quanto meno la necessità di adeguamento delle procedure e dei mezzi di coltura in PMA.
Si è compreso che un regime alimentare inadeguato può compromettere i fattori in gioco nella riproduzione fino ad arrivare ad una severa sterilità. Aspetti tipici delle società occidentali attuali, come il sotto e il sovrappeso, l’obesità per le donne come per gli uomini, il tabagismo, consumo eccessivo di alcoolici, come anche un’eccesso di attività fisica, se non controbilanciata da un’inadeguata nutrizione, possono costituire rischio di sterilità.
Secondo una ricerca recente in Germania in un campione di coppie sterili, si evidenzia come il 7,3% delle donne sia sottopeso, il 25% sovrappeso o obeso (oltre il 50% gli uomini), mentre il 22% delle donne (meno gli uomini) siano impegnate in attività sportive intense – per più di 4,5 ore alla settimana – senza essere supportate da una adeguata nutrizione. Non solo le donne non si rendono conto dell’importanza dell’impatto della nutrizione sulla fertilità ma neanche gli operatori sanitari paiono indagarvi questo fondamentale aspetto (SCHILLING K. e al., «Arch. Gynecol. Obstet.» 2012; 286: 1307-14).
In sintesi, possiamo dire che la fertilità non è ne gratuita, né casuale, comporta un costo energetico, ma necessita anche di un equilibro metabolico adatto a ciascun individuo, poiché siamo tutti diversi l’uno dall’altro. In assenza di questo equilibrio insorge la sterilità ad ogni livello dell’apparato riproduttivo della coppia, non solo quindi della donna, ma anche dell’uomo.
La gravidanza comunque insorta può esitare, per queste ragioni, in aborto, oppure in patologia della gravidanza (ipertensione, diabete, preeclampsia), o ancora in parto prematuro o basso peso alla nascita.
Questo tipo di problematica riproduttiva è presente, contrariamente a quanto si pensa, e non per carestia, prevalentemente nelle società occidentali. Infatti la sterilità, nonostante il benessere, è calcolata come incidenza dal 3,5% al 16,7% nelle società occidentali e dal 6,9% al 9,3%, nei paesi in via di sviluppo, dove prevalgono le infezioni quale causa di sterilità (BOIVIN J. E al., «Hum Reprod.» 2007; 22: 1506-12).
Secondo uno studio prospettico spagnolo si è evidenziato che l’alta probabilità di fertilità risulta correlata a un’alimentazione di tipo mediterraneo piuttosto che di tipo occidentale (TOLEDO E. e al., Dietary patterns and difficult conceiving: a nested case-control study, in «Fertil. Ster.» 2011, 96: 1149-53). Ma chi ha oggi ancora un’alimentazione di tipo mediterraneo?
In campo riproduttivo quale tipo di intervento strategico sarà prioritario per la tutela della salute delle future generazioni: clinico (centrato sullo stile di vita) o tecnologico (trascurando la causa del problema)?
Se si ricorre alla PMA si deve sapere che in tutte le sue applicazioni, oltre al rischio insito in alcune tipi di sterilità femminile (ad esempio obesità, età avanzata) e maschile (come le aneuploidie spermatiche, le frammentazioni del DNA) si sommano l’iperstimolazione ovarica, la manipolazione in vitro di spermatozoi e oociti, la crescita in coltura in vitro degli embrioni.
Tutte queste situazioni costituiscono, ognuna a modo suo, ulteriori fattori di rischio, in quanto di per sé causano alterazioni epigenetiche. Ci si può porre anche il problema se sia la sterilità in sé a causare o a contribuire a queste alterazioni epigenetiche, di fatto queste domande non cambiano la sostanza: di per sé la fertilizzazione in vitro aggiunge delle variabili potenzialmente negative.
Ad ogni modo, ogni persona con un proprio patrimonio genetico ha subito nel corso della vita intrauterina degli stimoli a cui si è adattata attraverso modificazioni epigenetiche, in parte suscettibili di modifiche anche dopo la nascita. Il che (cosa nostra madre ha mangiato e fatto durante la gravidanza e l’allattamento ci rende uno diverso dall’altro: costituisce una ricchezza della nostra diversità, addirittura in caso di gemelli monozigoti. C’è molto di buono in queste modificazioni epigenetiche di codifica che accadono nella fase embrionale e intrauterina. Ma se tali modificazioni avvengono durante un processo di fertilizzazione in vitro, che comporta una situazione di elevato stato infiammatorio, esitano esitano in un maggior rischio di salute dovuto ad alterazioni epigenetiche embrionali e quindi placentari (NELISSEN E.C. e al. 2013; LOU H e al. 2014).
È ormai acquisizione diffusa tra gli esperti che la manipolazione degli ovociti e degli embrioni dovrebbe essere ristretta al minimo o il vantaggio di una specifica tecnica (esempio, la selezione durante la coltura embrionale e il transfer in utero allo stadio di blastociti) dovrebbe dimostrare quanto meno di superare gli effetti epigenetici negativi (durante la coltura embrionale prolungata), dato che molte decisioni vengono prese nel campo della fertilizzazione in vitro senza evidenza di reale beneficio e non poggiano su basi scientifiche, poiché mancano studi conclusivi (El NAJJ N. e HAAF T., Epigenetic and art, «Fertil. Steril.» 2013, 99: 632-641).
Sugli effetti negativi della coltura in vitro (danno all’embrione attraverso diffuse alterazioni dell’omeostasi metabolica con stress ossidativo di sistema e disfunzione mitocondriale, che esitano in obesità e diabete in età adulta) vi sono due studi recenti di sperimentazioni sui topi (CALLE A e al, Long-term and transgenerational effects of in vitro colture on mouse embryos, «Theriogenology» 2012; FEUER S.K. e al., Use of a mouse in vitro fertilization model to understand the developmental origins of health and disease hypothesis, in «Endocrinology» 2014)
Si evidenziano non solo modificazioni epigenetiche dovute alla coltura in vitro, che causano severe alterazioni nell’espressione dell’m RNA embrionale associate a riduzione di qualità embrionaria, ma che pure persistono comportando in età adulta patologie fisiche e neurocomportamentali e inoltre vengono trasmesse alla prole.
Dinanzi alla sterilità allora quale strategia riproduttiva utilizzare?
Si potrebbe correggere gli squilibri nutrizionali per migliorare la qualità dell’ovulazione e giungere a gravidanza spontanea con una migliore prognosi di salute rispetto all’applicazione della PMA (vedi tab. 1), infatti l’applicazione della PMA comporta di per sé la perpetuazione del rischio produttivo e di salute nella prole, costituendo un reale danno a livello di salute di popolazione.
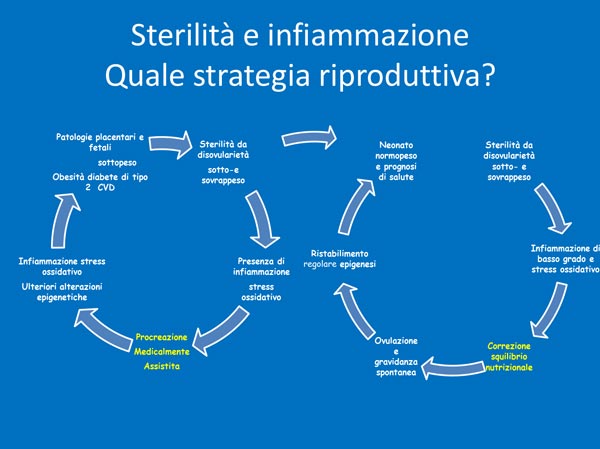
Tabella 1. Fertilità e infiammazione: quale strategia riproduttiva?
Da più parti ormai infatti si afferma la necessità di esaminare la questione dei mezzi e dei tempi di coltura in PMA, dato che le formulazioni dei mezzi di coltura non sono ancora ottimali per embrioni umani e generalmente non ne sono note le composizioni, mentre sarebbe pure necessario un approfondito follow-up dei parametri di salute dei bambini nati da PMA, in quanto è troppo presto per escludere importanti implicazioni di salute a lungo termine dei nati, già evidenziate in più studi. (PINBORG A. e al.,«Hum. Reprod.» Update 2013; 19: 87-104; NELISSEN E.C. e al., «Hum. Reprod.» Update 2013; 28: 2067-74; SUNDE A., BALABAN B., «Fertil. Steril.», 2013; 100: 310-8).
Alcuni rischi documentati per i nati da tutte le procedure di PMA sono noti, come i problemi perinatali (prematurità, mortalità e morbilità perinatale), invece meno noti sono predisposizione a obesità, patologie cardiovascolari, diabete tipo 2, depressione, ritardo mentale, autismo in età infantile e adulta; c’è un rischio di malformazioni genito-urinarie, cardiovascolari, gastrointestinali, muscolo-scheletriche; di alterazioni epigenetiche rare (Sindrome di Beckwith-Wiedemann, S. Angelman, S. Goldenhar); sono descritti poi i rischi specifici per micromanipolazioni e colture (allo stadio di blastocisti, maturazione in vitro) e rischi tumorali in bambini (leucemie, rabdomiosarcomi).
Le complicanze perinatali sulla salute dei nati comporta anche una maggiore ospedalizzazione e morbilità, con costi elevati per la società.
Per motivi di violazione della riservatezza di dati sensibili, in Italia, purtroppo e a differenza di altri paesi che tendono a tutelare la salute della società in toto e che hanno fornito i dati esposti, non abbiamo un registro nazionale sullo stato di salute dei bambini nati in PMA.
Per la PMA eterologa oltre ai rischi sopracitati trattandosi sempre di una particolare forma di PMA si aggiungono i problemi psicologici per la PMA di I° e “II° livello; dal punto di vista medico sono gravidanze a rischio per la “ricevente” (elevata incidenza di TC, ipertensione, preeclampsia, diabete, emorragie post-partum, mentre i neonati presentano più probabilmente sottopeso, necessità di ricovero in terapia intensiva, patologie respiratorie, mortalità perinatale, malformazioni con un’incidenza superiore ai bambini nati da mamme omologhe (SHIRM A. e al., «Perinat. Med.», 2010; 38: 645-50; TAQLAUER ES e al., «Placenta» 2013; 34: 385-7).
Quel che però generalmente non si considera è che la tecnica cosidetta di “ovodonazione” costituisce a tutti gli effetti un allotrapianto, mentre le gravidanze fisiologiche sono per metà geneticamente correlate alla madre, quindi solo un emi-allotrapianto. Quali saranno i rischi a lungo termine per riceventi che vanno incontro a gravidanze diverse da sé? La letteratura scientifica evidenzia aspetti legati al rischio di sviluppo di malattie autoimmuni non solo per le riceventi ma anche per i bambini. Di questi rischi non è previsto alcun monitoraggio né le riceventi sono avvisate.
Del resto tutte le donne recano dentro di sé la memoria immunologica delle gravidanze che hanno avuto e anche a trent’anni di distanza nel nostro sangue circolano le cellule dei nostri figli. Se quelle cellule non sono dei nostri figli genetici ci si chiede cosa succederà in futuro dal punto di vista autoimmune per figli e gestanti. Questi sono aspetti evidenziati dalla letteratura scientifica e assolutamente sottovalutati.
Tanto che c’è attualmente una crescente preoccupazione riguardo alla sicurezza di tutte le procedure di PMA e si raccomanda il monitoraggio delle gravidanze perché pochissimi studi seri riportano gli esiti di madri e neonati (DE WAAL E. e al., «Biol. Reprod.» 2014, 90 (2): 22; BRAAKHEKKE M. e al., «Hum. Reprod.», 2014; e-pub), mentre già uno studio nel 2002 (THOMPSON J.G. e al., Epigenetic risks related to assisted reproductive technologies: short-and long-term consequences for the health of children conceived through assisted reproduction technology: more reason for caution?, «Hum. Reprod.» 2002, 17: 2783-86) richiamava l’attenzione su queste preoccupazioni, evidenziando la necessità di un intenso monitoraggio a lungo termine della salute dei bambini e degli adulti nati attraverso pratiche di PMA a seguito di considerazioni sulle modificazioni epigenetiche e affermando che «dovendo attendere tali studi […], fino al loro completamento le procedure di PMA rimangono una serie di esperimenti in corso».
Lo stesso gruppo, a distanza di dieci anni, nel 2012, conclude: «I progressi per aumentare il successo della IVF sono assolutamente inferiori al previsto sia per le difficoltà metodologiche insite sia per la bassa priorità alla ricerca in sterilità, con sviluppi definiti piuttosto dal progresso tecnico rispetto a quello scientifico.
Oggi siamo quasi completamente ignoranti sul metabolismo dell’embrione in situ ( tuba e utero), […] e nella fase infantile degli studi sul dialogo tra l’embrione in coltura e con la madre in vivo: tutto ciò che sappiamo da tanto tempo è la superiore qualità di embrioni concepiti in vivo» (LEESE H.J., Metabolism of the preimplantation embryo: 40 year on, «Reprod.» 2012, 143: 417-27).
Tutte queste considerazioni hanno portato medici esperti nella PMA a scrivere una riflessione sulla prestigiosa rivista scientifica inglese BMJ del 2014 (Are we overusing IVF? The Evidence based IVF Group, 348: 252-6): «Come società siamo di fronte ad una precisa scelta: possiamo continuare a offrire un accesso precoce all’IVF e non basato sull’evidenza alle coppie con problemi di fertilità o seguire un percorso che ci mette alla prova per poter documentare che i nostri interventi sono efficaci e sicuri e inoltre ottimizzare le procedure di IVF. Noi dobbiamo sentire il dovere verso tutte le coppie sub fertili e i loro potenziali figli di usare la IVF.
Noi dobbiamo sentire il dovere verso tutte le coppie sub-fertili e i loro potenziali figli di usare la IVF con giudizio e di dare la sicurezza che per prima cosa non stiamo facendo loro del male». Rimarcano come la PMA sia più un investimento in termini di guadagno che di esiti in gravidanze e nascite in salute, donde la necessità di conoscenza sulla migliore pratica e sicurezza a lungo termine, dato che « gli esiti in termine di salute dei bambini nati da IVF sembrano essere più poveri di quelli concepiti naturalmente».
Sempre più sovente altri studiosi (WHITELAW N. e al., Epigenetic status in the offspring of spontaneous and assisted conception, in «Hum. Rep.», e-pub, may 8 2014) condividono la stessa preoccupazione. Si sottolinea negli studi citati che, a differenza della tendenza attuale, per la salute delle generazioni future sia meglio trattare la sterilità attraverso modificazioni dello stile di vita e se si procede alla PMA bisogna farlo con stimolazioni soffici, con minori manipolazioni (compresa la crionservazione), evitando l’ICSI inutile e trasferendo l’embrione il prima possibile. Diventa quindi chiaro quanto sia urgente trovare nuove strategie pubbliche per tutelare la salute delle prossime generazioni.
Si allegano per completezza dati tratti dalla Relazione 2013 del Ministero della Salute relativa ai dati del 2011 sull’applicazione della PMA in Italia.
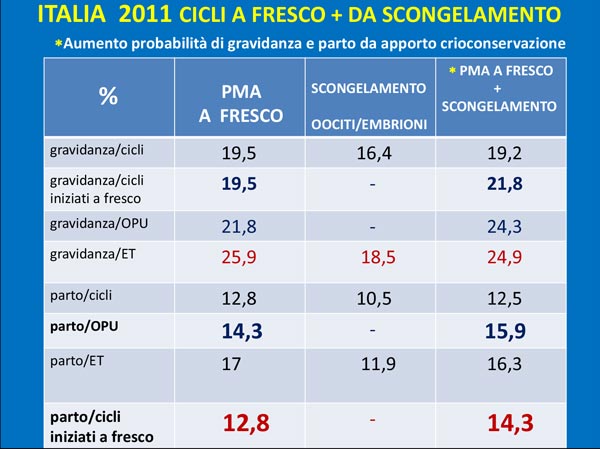
Tabella 2. Italia 2011 cicli a fresco + da scongelamento © Ministero della Salute
Il 12,8 % per parto/cicli iniziati a fresco vuol dire che in Italia nascono 12,8 bambini su 100 tentativi di PMA a fresco e se a questi si aggiungono i nati da PMA con scongelamento di embrioni o oociti, si ottiene il 14, 3%, ovvero su 1000 tentativi iniziali di fertilizzazione in vitro nascono 128 bambini da fresco + 15 da crioconservato. Questo è l’apporto reale della crioconservazione alle probabilità di successo in PMA in Italia.
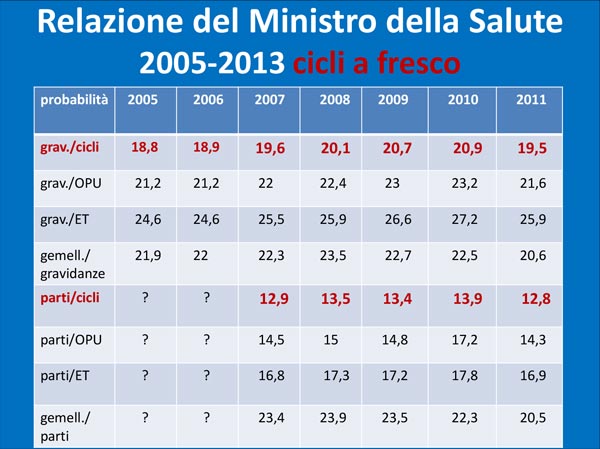
Tabella 3. Relazione del Ministero della Salute 2005-2013 cicli a fresco © Ministero della Salute
Dalla Relazione ministeriale si può notare che nel corso degli anni non vi è stato, come immaginato, un aumento di probabilità di successo, infatti nel 2007 e nel 2008 riscontriamo un maggior numero di gravidanze per cicli a fresco (13,5%) rispetto al 2011 (12,8 %), mentre l’apporto della crioconservazione non ha sostanzialmente determinato un significativo aumento di successo negli anni, contrariamente alle previsioni.
*Clementina Peris
Medico specialista in Ginecologia e Ostetricia
Già responsabile della Struttura Semplice Dipartimentale ASO OIRM – S. Anna di Torino «Ginecologia Endocrinologica e Terapia della Sterilità»
Docente Master in Bioetica presso la Facoltà Teologica dell’Italia Settentrionale – sezione di Torino
1 Trascrizione dell’intervento della dottoressa Clementina Peris al Convegno «Vita prenatale: inizio di un viaggio», 14 giugno 2014, Centro Congressi Santo Volto di Torino. Revisione del testo a cura della dott.ssa Peris
© Bioetica News Torino, Luglio 2014 - Riproduzione Vietata