Un’altra frontiera dei trapianti è stata abbattuta. La notizia di un “trapianto a cuore fermo” eseguito nei mesi scorsi nel quale fegato, due reni e un polmone prelevati da un corpo senza più battito cardiaco ha catturato l’attenzione dei media. Dopo il trapianto da vivente e quello “a cuore battente” nei pazienti in morte cerebrale ecco una nuova strada che apre scenari di speranza. Ciò conferma, pur tra molte difficoltà, l’eccellenza del Sistema Sanitario Italiano, laddove operatori competenti ed entusiasti, giorno dopo giorno, assistono migliaia di cittadini, sia nell’ordinario, sia, come nel caso del trapianto, nella straordinarietà. Marinella Zanierato, medico anestesista presso l’Ospedale «Città della Salute e della Scienza» di Torino, ha coordinato il progetto. Per chiarirci cosa voglia dire questo tipo di intervento, quali le criticità e quali le prospettive, poniamo a lei alcune domande.

Dottoressa, ci racconti come sono andate le cose.
Nei mesi scorsi alle Molinette, è stato effettuato un prelievo multiorgano a cuore fermo in una donna di 57 anni, deceduta in seguito ad un infarto così esteso che aveva fermato il suo cuore in maniera definitiva. La signora aveva avuto un arresto cardiaco prolungato, trattato massimalmente anche mediante circolazione extracorporea, per permettere al suo cuore di recuperare. Purtroppo il recupero non vi è stato ed ai curanti non è rimasto che arrendersi e dichiarare il decesso.
In vita la signora aveva espresso la volontà di donare i propri organi e lo aveva lasciato scritto. Dai racconti della figlia abbiamo imparato a conoscere Angela e la sua vita, dedicata agli altri, alla figlia in particolare ed all’adorato nipotino. Angela ha potuto donare reni, fegato e polmoni. Si è trattato del primo caso di donazione e successivo trapianto da soggetto deceduto in seguito ad arresto cardiaco eseguito presso «Città della Salute e della Scienza».
Il “trapianto a cuore fermo” è una novità?
No, è una pratica consolidata a livello internazionale, in particolare in USA, Regno Unito, Belgio, Olanda, Spagna e Francia. L’esperienza con donatori “a cuore fermo” (DCD) si sta diffondendo anche in Italia e i risultati in merito alla sopravvivenza dei riceventi sono incoraggianti. Si tratta di un importante passo avanti nell’attività di donazione e trapianto italiana, che ha la potenzialità di allargare il numero degli organi disponibili per il trapianto. Questa tecnica è stata introdotta nel nostro Paese circa una decina di anni fa, ma inizialmente non ha avuto grande diffusione per la complessità dell’apparato organizzativo che richiede questa tipologia di donazione. I donatori a cuore fermo sono soggetti nei quali la morte viene accertata in seguito ad un arresto cardiaco che può verificarsi in due distinte situazioni:
1. In soggetti nei quali la morte per arresto cardiaco avviene in modo improvviso, solitamente in contesto extra-ospedaliero e nei quali, dopo il trasporto in ospedale e dopo che ogni tentativo di rianimazione viene giudicato inutile, si procede alla interruzione delle manovre rianimatorie per un tempo adeguato alla determinazione della morte cardiaca (cosiddetto no-touch period di 20 minuti)
2. In soggetti ricoverati in Rianimazione nei quali l’arresto cardiaco è “atteso” per la gravità delle condizioni cliniche, nei quali il trattamento massimale in corso non è efficace.
La particolarità di questa donazione sta proprio nel fatto che è resa possibile grazie alla messa in atto di una serie di procedure che hanno permesso di ripristinare la perfusione degli organi oramai non più perfusi perché il cuore si ferma.
Dottoressa Zanierato può spiegarci qualcosa di più?
La donazione a cuore fermo è una nuova sfida per noi, ma nasce tanto tempo fa. Quando il cardiochirurgo sudafricano Christian Barnard effettuò il primo trapianto di cuore della storia, lo fece proprio prelevando il cuore a una donatrice deceduta in seguito ad arresto cardiaco. Sino ad allora l’accertamento con criteri cardiologici era l’unica modalità per dichiarare la morte. Era il 3 dicembre del 1967. Nel 1968 ad Harvard vennero definiti i criteri per la diagnosi della morte con criteri neurologici in seguito alla osservazione che molti pazienti ricoverati in Rianimazione, collegati ad un ventilatore meccanico e quindi con il cuore battente, erano in realtà deceduti per la presenza di lesioni cerebrali così gravi ed irreversibili da determinare la morte dell’intero cervello. Per cui, mentre la definizione di morte è unica (perdita irreversibile della funzione dell’intero cervello), diverso è il modo con cui viene accertata (criteri cardiologici o neurologici).
Il prelievo tradizionale degli organi da donatori deceduti avviene in soggetti la cui la morte è accertata con criteri neurologici, nei quali il cuore continua a battere perché ossigenato artificialmente da una macchina. Nei donatori a cuore fermo, invece, il decesso è dichiarato in seguito alla cessazione dell’attività cardiaca, per cui gli organi non sono più ossigenati e perfusi, come è avvenuto nella donatrice della settimana scorsa. La legge italiana stabilisce i tempi e i criteri con cui viene accertata la morte: nella morte cerebrale il tempo stabilito prevede sei ore di osservazione, nella morte di origine cardiaca, il periodo di osservazione prevede 20 minuti di registrazione di elettrocardiogramma.
Questa tempistica così diversa tra le due modalità di accertamento e il potenziale rischio di danneggiare gli organi durante la fase di arresto cardiaco, fa ben capire come le procedure attuate per poter permettere la donazione in soggetti a cuore fermo sia molto complessa. Da un lato il cuore fermo non perfonde gli organi che rapidamente diventano non più idonei al prelievo e quindi al trapianto perché non vitali; dall’altro, i 20 minuti rappresentano il tempo utile per poter iniziare una preservazione efficace per permettere la donazione a chi lo ha espresso in vita.
Il prelievo di organi dalla donatrice è stato possibile grazie alla messa in atto di una circolazione extracorporea (extracorporeal membrane oxygenation, ECMO) addominale che ha consentito di mantenere “vitali” gli organi grazie alla perfusione e all’ossigenazione post-mortem per 4 ore. Questa procedura è stata adottata per mantenere la normale temperatura corporea e per ritardare il danno da ischemia ( mancata circolazione del sangue a causa del cuore fermo per l’arresto cardiaco), principale responsabile della mancata utilizzazione di tali organi per il trapianto.
Quali sono le principali novità di questa nuova tecnica?
Il fattore che mostra di avere maggior peso nel condizionare l’esito dell’organo donato è il tempo di ischemia calda (warm ischemia time, WIT). L’utilizzo dell’ECMO regionale o perfusione regionale normotermica (Normothermic Regional Perfusion, NRP), ha la potenzialità di rendere possibile un certo grado di recupero del danno ischemico; consente inoltre una esauriente valutazione funzionale degli organi addominali e permette anche di guadagnare il tempo necessario per l’attivazione delle equipe e delle procedure di prelievo. In questo contesto, la perfusione extracorporea non è più una strategia terapeutica ma una tecnica che permette la protezione e valutazione degli organi da donatore a cuore fermo. La NRP offre la possibilità di ripristinare i processi metabolici e le riserve energetiche cellulari, riparare il danno cellulare, rimuovere i radicali liberi e prevenire il danno ischemico irreversibile.
La perfusione regionale avviene mediante un circuito extracorporeo (ECMO), attraverso la cannulazione di una vena ed un’arteria femorali. Il circuito ECMO consiste in una pompa centrifuga e un ossigenatore connesso ad un riscaldatore ed a una sorgente di gas (aria e ossigeno). Ciò che differenzia sostanzialmente questa tecnica dalla assistenza extracorporea applicata per l’insufficienza respiratoria o cardiocircolatoria, è la selettiva perfusione degli organi addominali (figura 1). Le perfusione regionale normotermica è una strategia “protettiva” che permette di ottimizzare la preservazione dell’organo e di minimizzare la risposta infiammatoria.
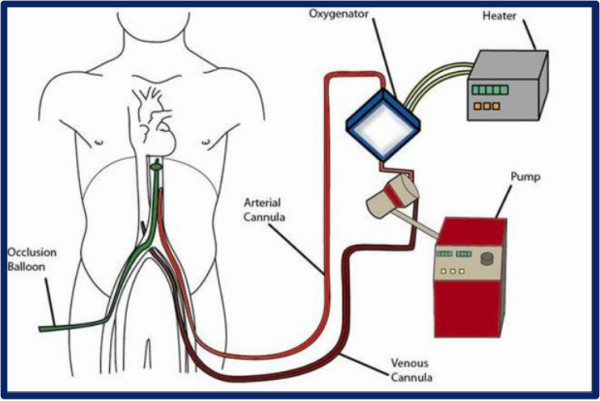
I polmoni in questa tipologia di donatori, vengono preservati unicamente con la ventilazione in assenza di flusso sanguigno. Fu dimostrato negli anni ’90 la capacità del polmone di resistere all’ischemia (mancanza di flusso sanguigno), mantenendo esclusivamente un flusso di ossigeno.
Gli organi prelevati da DCD richiedono, tuttavia, una attenta valutazione prima del trapianto. Negli ultimi anni, in molti programmi di donazione da DCD, è stata introdotta una valutazione funzionale “ex-situ”, mediante perfusione acellulare (senza sangue) normo o ipotermica (Perfusion Machine) dell’organo prelevato. Tale perfusione ha una duplice funzione: da un lato verosimilmente “ripara” il danno da riperfusione, offrendo substrati specifici in un fisiologico metabolismo aerobio; dall’altro, permette una più accurata valutazione funzionale dell’organo prima del trapianto.
Anche gli organi di Angela, prima del trapianto sono stati sottoposti a perfusione ex-situ, valutati e rigenerati, prima di essere considerati idonei al trapianto.
Che cosa vuol dire per un ospedale un intervento di questo tipo?
Il processo donazione-trapianto di organi da donatore a cuore fermo è complesso, multifasico e richiede la presenza contemporanea di più specialisti che operano in team. Ogni fase è essenziale per il buon esito dell’intero processo. Le fasi principali sono le seguenti: identificazione del potenziale donatore, valutazione clinica di idoneità del donatore, accertamento della morte, verifica del consenso, preservazione degli organi prima del prelievo, prelievo degli organi, preservazione degli organi dopo il prelievo e loro valutazione, trapianto.
Per essere efficiente tale organizzazione deve permettere, oltre a quella strettamente clinico – assistenziale del donatore, la gestione ottimale di compiti assai diversi e sempre impegnativi quali: rapporto con i parenti del donatore; comunicazioni con i Centri di Riferimento Interregionali Regionali di trapianto e con tutti gli Operatori locali coinvolti; adempimenti burocratici, normativi e legali ecc. Nell’ arco di tempo di poche ore decine di specialisti, di discipline e strutture diverse, interagiscono con l’evento donazione-prelievo-trapianto. In queste ore è necessario accertare la morte con i criteri stabiliti dalla legge italiana; valutare l’idoneità del donatore e dei singoli organi; consultare le liste d’attesa ed individuare i possibili riceventi; eseguire i test immunologici per verificare la compatibilità donatore-ricevente; assegnare gli organi disponibili ai pazienti selezionati, garantendo innanzitutto le urgenze e i programmi nazionali; convocare i riceventi nei centri trapianto e valutarne le condizioni cliniche; eseguire i prelievi di organi e tessuti; effettuare i trapianti e seguire i follow-up.
Tutto il processo si snoda attraverso le rianimazioni, i centri di coordinamento, i laboratori, i centri trapianto, le centrali di soccorso e le compagnie di trasporto. Un grande coinvolgimento quindi di competenze non solo cliniche, ma anche logistiche che devono integrarsi le une alle altre. È un processo che garantisce sempre qualità e sicurezza.
Quali possibilità apre per la trapiantologia?
Il trapianto è l’unica opzione efficace per molte patologie end-stage. Purtroppo, il numero di donatori idonei al prelievo multiorgano è decisamente inferiore rispetto ai pazienti in lista d’attesa. Attualmente risultano in attesa di trapianto più di 9000 pazienti a fronte di circa 3500 trapianti effettuati ogni anno. A seconda dell’organo, il tempo medio di attesa in lista può variare molto all’interno di un range tra 1,5 anni (per chi attende un fegato) e 3,5 anni (per chi attende un cuore). È evidente che per chi attende un organo salvavita come cuore o polmone il tempo d’attesa corrisponde ad una aumentata probabilità di morire prima di ricevere l’organo stesso. Ciò ha spinto molti paesi, nell’ultimo decennio, a sviluppare nuove strategie atte ad espandere il numero di donatori. I donatori a “ cuore fermo” , rappresentano attualmente una importante risorsa di organi disponibili per trapianto per molti paesi nel mondo e anche per l’Italia.
In Spagna, la donazione a cuore fermo rappresenta il 28-30% di tutte le donazioni, mentre in UK questo valore sale al 40%. In Italia, rappresenta 8-10% delle donazione. «Città della Salute e della Scienza» ha iniziato a contribuire a questo importante traguardo. La donazione a cuore fermo rappresenta anche per l’Italia una reale possibilità di incrementare il numero di donatori e di ridare la vita a pazienti in lista d’attesa. Quest’anno, dai dati riportati dal Centro Nazionale Trapianti, il numero di donatori a cuore fermo supera il centinaio.
La ricerca ha individuato nella possibilità di preservare e “curare” gli organi prima del trapianto, la reale innovazione in ambito trapiantologico. Gli organi dei donatori a cuore non battente, in assenza di circolazione sanguigna, devono essere preservati molto precocemente ed efficacemente, immediatamente dopo la cessazione della circolazione. Le tecniche di preservazione possono essere diverse. Per gli organi addominali (reni, fegato, pancreas) si può utilizzare un sistema di perfusione con circolazione extracorporea, detta anche perfusione normotermica regionale in-situ ( nel cadavere). La perfusione regionale normotermica è una strategia “protettiva” che permette di ottimizzare la preservazione dell’organo e di minimizzare il danno ischemico. Tuttavia, può non essere sufficiente. Negli ultimi anni, è stata introdotta una valutazione funzionale “ex-situ”, dell’organo prelevato. Tale perfusione ha una duplice funzione: da un lato verosimilmente “ripara” il danno da riperfusione, offrendo substrati specifici in un fisiologico metabolismo aerobio; dall’altro, permette una più accurate valutazione funzionale dell’organo prima del trapianto.
Questa tecnica, per il polmone, prende il nome di ex-vivo lung perfusion (EVLP). Prevede che i polmoni prelevati da un donatore siano considerati sani ma temporaneamente deteriorati dal punto di vista funzionale in seguito agli eventi collegati con la morte e quindi non potrebbero essere utilizzati per il trapianto. La tecnica di ricondizionamento consente di rimuovere dai polmoni mediatori chimici dannosi, acqua in eccesso nel tessuto polmonare e di aspirare le secrezioni all’interno dei bronchi. Alla fine di tale trattamento, che dura circa 4 ore, è possibile effettuare una valutazione della funzione degli organi e quindi decidere se effettivamente sono trapiantabili. Tale metodica consente di recuperare organi scartati in prima istanza ma potenzialmente validi dopo opportuno trattamento, quindi sicuramente è uno strumento valido per aumentare le chance di trapianto per un paziente in lista d’attesa. Questa tecnica è applicata anche per il fegato ed i reni.
Dottoressa Zanierato, un pensiero conclusivo sui donatori e sulle loro famiglie.
Il trapianto è possibile solo se vi è un donatore. Il corpo del donatore esprime sempre la sua grandezza e sacralità; in esso si realizza il più profondo atto di generosità e amore. Nel discorso tenuto al XXVIII Congresso Internazionale dei Trapianti d’ organo (Roma, settembre 2000), Sua Santità Giovanni Paolo II pronunciò le seguenti parole: «⌈…⌉ogni intervento di trapianto d’organo, ha generalmente all’origine una decisione di alto valore etico: la decisione di offrire, senza ricompensa, una parte del proprio corpo, per la salute ed il benessere di un’altra persona. Proprio in questo risiede la nobiltà del gesto, che si configura come un autentico atto d’amore.⌈…⌉».
Nel difficile processo di donazione ci si confronta con emozioni e sentimenti molto intensi e contradditori, quali la disperazione per la perdita del congiunto, la solitudine, il dolore, la rabbia, la generosità. Gli aspetti di comunicazione e di relazione con i familiari del potenziale donatore rappresentano uno dei passaggi più critici dell’intero processo, in particolare quando il decesso avviene in maniera inaspettata, dopo un arresto cardiaco. La relazione con la famiglia inizia sin dal momento dell’entrata del paziente in rianimazione e prescinde dal destino che avrà quel soggetto. Generalmente la proposta di donazione si apre con la richiesta ai familiari se sono a conoscenza di eventuale espressione manifestata in vita dal soggetto. Grazie a tutte le famiglie dei donatori.
La Medicina, frutto dell’ingegno e della scienza umana, non cesserà mai di stupirci. Il “trapianto a cuore fermo” ne rappresenta un’ulteriore conferma, una conquista, un traguardo superato che ci apre ad un futuro nel quale sempre più pazienti in attesa di un organo troveranno una risposta. Il divario tra donatori e riceventi non sarà mai colmato, ma queste nuove tecniche possono ridurre in modo significativo la forbice riducendo le liste le liste di attesa e alimentando in modo realistico le speranze di molti malati. Chi aspetta un organo non aspetta altro, citava qualche tempo fa uno slogan. Ed è effettivamente così, ma nessuna tecnica, per quanto raffinata ed all’avanguardia possa essere, può fare a meno del fattore umano, cioè di un gesto generoso, altruistico, attraverso il quale un essere umano, donando gli organi, dona se stesso e dona la vita ad altri. La donatrice torinese con il suo gesto ha ridato speranza a quattro persone. Una vita dedicata agli altri sino alla fine, una santità nel quotidiano, “la santità della porta accanto” di cui parla Papa Francesco, ma soprattutto un esempio per tutti.
© Bioetica News Torino, Dicembre 2019 - Riproduzione Vietata